Простая сигнализация для дома, дачи, гаража — своими руками
Существует множество промышленных охранных сигнализаций, которые можно купить или просто обратиться в фирму, занимающуюся установкой охранных сигнализаций в доме или на даче. Статья для тех, кто не любит тратить деньги. Схем самодельной охранной сигнализации тоже много но, в основном, они требуют профессиональных радиотехнических знаний и навыков. Здесь описывается принцип и схемы самых простых, тем не менее надежных методов и автономной устройств охраны от проникновения.
Сам принцип — при проникновении включается звуковая и (или) световая сигнализация — старый, проверенный способ отпугивающий воров в 98%. К стати, на 100% Вас не защитит ни одна, самая крутая, сигнализация и даже подключение на пульт охранной фирмы. Это как и машина — если ее заказали — не спасет ни что.
Но не будем так пессимистичны. Такие случаи очень редки, тем более если Вы не нефтяной магнат или тому подобное, и у Вас не пол дома (дачи) бриллиантов, то Вы под «заказ» точно не попадете.
Для самой простой сигнализации достаточно установить датчики проникновения на двери и окна (обычный геркон и магнит — стоят копейки) и подключить их к схеме сигнализации. Датчик устанавливается: магнит на движущую часть двери или окна, геркон на не движущую, таким образом, чтобы в закрытом состоянии геркон был замкнут.
Все герконы подключаются последовательно. Сигнализация будет срабатывать при разрыве цепи в любом месте. Ниже приведена общая схема такого устройства.
Сигнализация будет срабатывать при разрыве цепи в любом месте. Ниже приведена общая схема такого устройства.
Здесь:
И — извещатель (цепочка охранных датчиков),
Оп. — оповещатель, (звуковой, световой или комбинированный)
Р — реле управления
VT — транзистор (или тиристор)
R — резистор
S — выключатель, осуществляющий постановку/снятие с охраны,
Купр. — контакты реле, управляющие оповещением
Кбл. — контакты самоблокировки
+U — источник питания
При срабатывании извещателя включается устройство оповещения. Оповещение может быть световым, звуковым, комбинированным. Кроме того, при небольшой доработке, сигнал о срабатывании охранной сигнализации может передаваться на пульт, мобильный телефон и т.п.
Транзистор используется для того, чтобы инвертировать сигнал датчика и делает это следующим образом. Пока контакты извещателя замкнуты они замыкают базу транзистора на общий провод, ток базы равен нулю, ток коллектора, соответственно тоже.
Можно использовать схему, которая показывает как можно привести описанный инвертор к банальным контактам и вообще исключить радиоэлементы.
При подаче напряжения на реле через сработавший (замкнувшийся) контакт датчика сигнализации оно срабатывает, включая К упр. нужную систему (оповещения, передачи данных). Одновременно другая группа контактов блокирует контакты датчика и, независимо от его дальнейшего состояния, удерживает реле в сработавшем состоянии. Выключить теперь сигнализацию можно, разомкнув выключатель S. Повторно замкнув этот выключатель мы снова включим систему сигнализации в дежурный режим. Как видите, все более чем просто. Однако такая схема потребляет несколько больше энергии, так как катушка реле будет запитана в режиме охраны.
Существенный недостаток этой схемы — при срабатывании, ее отключить можно только вручную. Поэтому такая схема может использовать при непосредственно близости охраняемого объекта, например рядом стоящий гараж, сарай и т. п.
п.
Схема охранной сигнализации на реле времени
В основу построения следующей схемы охранной сигнализации взято реле времени К2 типа РВП72-3-221-ООУ4 или аналогичное, имеющее две группы контактов, одна из которых — К2.1 — срабатывает мгновенно, а вторая — К2.2 — с регулируемой задержкой в пределах от 1 до 180 секунд. Задержка устанавливается на 5 -10 секунд для того, чтобы при входе в помещение хозяин успел отключить сигнализацию кнопкой S3 (установленной в скрытом месте ) до срабатывания звукового или светового сигнала. Полное отключение сигнализации от сети осуществляется выключателем S1 (тумблер или любой другой на напряжение 220 В). Сигнальным датчиком положения двери является кнопка S4 (типа КМ2-1 или аналогичная малогабаритная), установленная на каркасе двери. Кнопка S2 устанавливается перед дверью в охраняемое помещение и она позволяет включить схему сигнализации в режим ОХРАНА после выхода. Реле К1 можно использовать любого типа с рабочим напряжением 220 В.
В режиме ОХРАНА данная схема не потребляет электроэнергию, но при срабатывании сигнализации сирена (или звонок) будет звучать до момента выключения сигнализации кнопкой S3 или тумблером S1 внутри квартиры. Тот же недостаток, что и в предыдущей схеме.
Чтобы устранить этот недостаток, схему надо дополнить еще одним реле времени КЗ, алогичным К2 ( на схеме показано пунктиром). Время срабатывания контактов КЗ.1 устанавливается на задержку 120- 180 сек. По истечению этого времени схема сигнализации отключит сирену и будет находиться в таком состоянии до включения режима ОХРАНА.
Точно так же Вы можете самостоятельно сделать простую авто сигнализацию для машины.
И еще одна схема самодельной сигнализации, использует только на одном реле времени.
Время звучания сирены (и/или света) задается в реле. В ждущий режим ОХРАНА схема перейдет после кратковременного обесточивания схемы, после срабатывания или же при первоначальном включении.
S1 — тумблер включения-выключения охранной сигнализации;
S2 — тумблер используется для временного отключения звонка (или сирены) во время контроля работы устройства охраны
В схеме используется тиристор VS1, благодаря чему обеспечивается пожарная и электрическая безопасность. На цепи охранных датчиков не будет опасного для жизни напряжения. Данная схема позволяет в цепь охраны последовательно подключать много датчиков. На стекла окон можно установить датчики в виде приклеенной по периметру полоски из металлической фольги. Они срабатывают при разбивании стекла. Естественно подойдут любые герконовые, в любом количестве. Все соединяются последовательно в общую сигнальную сеть. Перед постановкой на охрану, проверьте, закрыты ли окна, Все датчики, кроме входной двери, должны быть в замкнутом положении.
Можно использовать аналогичный другой тиристор. При этом возможно потребуется подобрать резистор R1. Тип резистора — ПЭВ-10 или аналогичный с допустимой мощностью 7.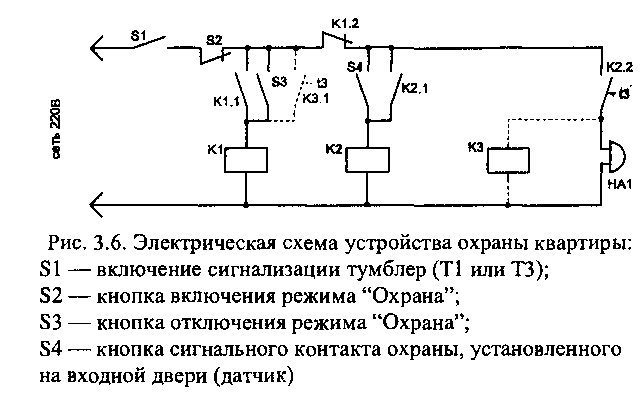 ..10 Вт. Возможно также применить несколько последовательно соединенных резисторов меньшего номинала.
..10 Вт. Возможно также применить несколько последовательно соединенных резисторов меньшего номинала.
При разрыве цепи охранных датчиков срабатывает реле К2 (такое же, как и на предыдущей схеме) и своими контактами К2.1 стает на самоблок. Также срабатывает реле К1, которое выключится через заданное время (120-180 сек.) контактами К2.2.
Реле К1 позволяет подключать мощную выходную нагрузку. В качестве источника звука можно использовать любую сирену, например СС-1 или любой мощный звонок на Ваше усмотрение.
Контрольная лампочка HL2 и тумблер S2 являются вспомогательными и их применение не является обязательным и не влияют на работу схемы.
Это самые простые схемы самодельной охранной сигнализации для дома, дачи или гаража, которые может собрать каждый самостоятельно своими руками.
Удачи в обеспечении сохранности Вашего имущества.
Простая сигнализация, схема, принцип работы
Этот материал предназначен тем, кого интересует простая сигнализация, которую можно сделать своими руками из подручных материалов. Кроме того, на этом примере можно доходчиво и просто пояснить принцип работы сигнализации для начинающих.
Кроме того, на этом примере можно доходчиво и просто пояснить принцип работы сигнализации для начинающих.
Здесь:
- ИО — извещатель (датчик) охранный,
- Оп. — оповещатель,
- Р — реле управления,
- VT — транзистор,
- R — резистор,
- S — выключатель, осуществляющий постановку/снятие с охраны,
- Купр. — контакты реле, управляющие оповещением
- Кбл. — контакты самоблокировки.
Принцип работы сигнализации достаточно прост, его поясняет схема на рисунке 1. При срабатывании извещателя включается устройство оповещения. Оповещение может быть световым, звуковым, комбинированным. Кроме того, сигнал о срабатывании сигнализации может передаваться на пульт, мобильный телефон.
Это самая простая сигнализация, которая на практике вряд ли применима, поскольку не имеет:
- фиксации состояния тревоги,
- возможности включения/выключения.
Следующие две схемы от этих недостатков избавлены. Различаются они только типом датчика (ИО) сигнализации. В схеме №2 используется извещатель с контактами, которые при срабатывании замыкаются (к слову таких датчиков меньше), а схема, представленная на рисунке 3 работает с датчиком, который при «тревоге» размыкает контакты. При приборы и датчики сигнализации более подробно написано здесь.
По принципу работы эти схемы идентичны. Транзистор используется для того, чтобы инвертировать сигнал датчика и делает это следующим образом. Пока контакты извещателя замкнуты они замыкают базу транзистора на общий провод, ток базы равен нулю, ток коллектора, соответственно тоже. При размыкании контактов датчика сигнализации через резистор R базовый ток открывает транзистор, который включает реле.
На рисунке 4 приводится схема, которая показывает как можно привести описанный инвертор к банальным контактам и перейти к схеме на рис.2, работу которой мы сейчас рассмотрим.
При подаче напряжения на реле через сработавший (замкнувшийся) контакт датчика сигнализации оно срабатывает, включая К упр.
Если датчиков несколько, то они объединяются в шлейф сигнализации.
Следует заметить, что принцип работы пожарной сигнализации от описанного практически не отличается, за исключением случаев, когда используются активные пожарные извещатели, например, дымовые.
© 2010-2021 г.г.. Все права защищены.
Материалы, представленные на сайте, имеют ознакомительно-информационный характер и не могут использоваться в качестве руководящих документов
Схемы сигнализации, самодельные охранные устройства
Схема сигнализации открывания входной двери
Устройство предназначено для звуковой сигнализации открывания двери. Можно использовать как охранную сигнализацию, и как просто сигнализатор открывания двери. Датчиком служит замыкающая кнопка датчик от двери легкового автомобиля. Такой датчик представляет собой кнопку, разомкнутую в нажатом …
Можно использовать как охранную сигнализацию, и как просто сигнализатор открывания двери. Датчиком служит замыкающая кнопка датчик от двери легкового автомобиля. Такой датчик представляет собой кнопку, разомкнутую в нажатом …
1 194 0
Сигнализация, срабатывающая при установке ключа в замок или попытке его взломаСхема охранной сигнализации для квартиры, которая работает с датчикомоткрытия замка. Датчик устанавливается на внутреннюю часть металлического корпуса дверного замка. И выдает импульс как при отпоре замка ключом, так и при любых других манипуляциях с ним при помощи отмычек или слесарных …
1 501 1
Самодельная сигнализация на основе датчика HC-SR501 и GSM телефона PHILIPS Е-1500Сейчас, в частности на Алиэкспресс, а так же и в магазинах в продаже бывает недорогой датчик движения (пир-датчик) HC-SR501. Он представляет собой модуль инфракрасного датчика движения. Выполнен в виде печатной платы, на которой есть трехконтактный разъем для подключения, два подстроечных резистора . ..
..
1 383 0
Очень простая сигнализация на основе пиродатчика HC-SR501Пиродатчик HC-SR501 представляет собой модуль инфракрасного датчика движения. Выполнен в виде печатной платы, на которой есть трехконтактный разъем для подключения, два подстроечных резистора для регулировки чувствительности и длительности выходного импульса, а так же перемычка «L/Н» при …
0 243 0
Муляж охранной сигнализации, питание мигающего светодиода от 220ВСейчас очень популярны муляжи камер видеонаблюдения, — стоят они дешево, но выглядят вполне внушительно, и своим видом способны отпугнуть «мало квалифицированного» вора. Но покупать муляж видеокамеры для имитации охраны, например, кладовки или сарая, не обязательно. Здесь вполне хватит …
0 232 0
Охранная сигнализация с датчиком пересечения ИК-луча (HS0038, CD4001)Сейчас в охранных системах наиболее популярны датчики движения, ведь они реагирует на перемещение в помещении живых существ. Но это удобно только в том случае, если нужно охранять пустое помещение, и, причем все сразу. А если нужно контролировать только вход в помещение, и, к тому же, в совсем …
Но это удобно только в том случае, если нужно охранять пустое помещение, и, причем все сразу. А если нужно контролировать только вход в помещение, и, к тому же, в совсем …
1 417 0
Простая самодельная радиосигнализация на модулях HC-SR501 и TX11SA-4, RX480E-4Если нужно охранять какое-то не сильно удаленное помещение, например, сарай, подвальное подсобное помещение, расположенный водворе гараж, оптимальным может быть вариант радиофицированной сигнализации. Когда один блок с датчиком находится «на объекте» а второй блок у владельца дома …
1 462 0
Простая автосигнализация на радиомодуле RX480-EСигнализация предназначена для охраны недорогого отечественного автомобиля. Она реагирует на открывания дверей автомобиля и на включение зажигания двигателя. При этом включается сирена, которая звучит столько времени, сколько дверь оставлена открытой или включено зажигание, но не менее 15-20 …
2 496 2
Простейшая сигнализация с датчиком движения HC-SR501Имея датчик движения HC-SR501, десяток переключающих кнопок, тумблер, источник питания 12V, транзистор IRLU024 и полупроводниковую сирену для автосигнализации, можно сделать весьма эффективную, но очень простую охранную сигнализацию для помещения.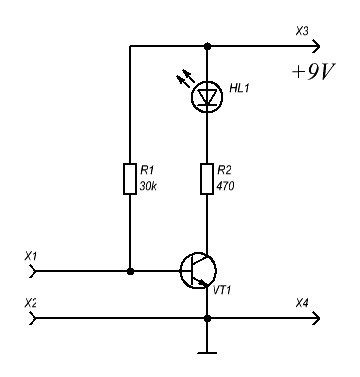 Сейчас, в частности на «Алиэкспресс» …
Сейчас, в частности на «Алиэкспресс» …
0 380 0
Охранная сигнализация с датчиком удараЭта охранная сигнализация реагирует на удары по поверхности или предмету, накоторый установлен датчик. Её можно установить на мотоцикл, автомобиль, другое транспортное средство, в том числе и лодку, катер, а так же и для охраны от взлома металлической двери, если охраняется складское помещение …
0 468 0
1 2 3 4 5 … 18Радиодетали, электронные блоки и игрушки из китая:
Схемы световой и звуковой сигнализации КИП и А
Схемы световой и звуковой сигнализации КИП и АПрограмма КИП и А
Здесь представлены и рассматриваются простые схемы световой и звуковой сигнализации для устройств и приборов КИП и А.
Внимание! Так как все схемы работают под напряжением 220 Вольт, опробование и наладка должна производиться квалифицированным персоналом с соответствующей группой допуска по электробезопасности.
Простая схема световой и звуковой сигнализации
Схема общей сигнализации, показанная на рисунке 1 содержит минимальное количество коммутационных элементов.
Рисунок 1. Простая схема световой и звуковой сигнализации КИП и А
S1…Si – нормально разомкнутые контакты реле приборов, замыкающиеся при достижении уставок приборов значений, при которых должна срабатывать сигнализация.
SB1 – Кнопка «Опробование». Имитирует срабатывание сигнализации. При нажатии загорается лампочка E1 и слышен звук сирены / звонка B1.
SB2 – Кнопка «Съем звука». Служит для отключения звука сигнализации. Световая сигнализация при этом продолжает работать.
K1.1 – нормально разомкнутый контакт реле K1.
K1.2 – нормально замкнутый контакт реле K1.
K1 – электромагнитное реле / пускатель, с рабочим напряжением 220 вольт переменного тока на катушке, с одним нормально замкнутым и одним нормально разомкнутым контактами.
E1 – лампа накаливания 220 вольт – световая сигнализация.
B1 – сирена / звонок, с рабочим напряжением 220 вольт переменного тока – звуковая сигнализация.
Принцип действия сигнализации
Контакты реле приборов S1…Si ( их может быть неограниченное количество), запараллелены между собой и с кнопкой «Опробование» сигнализации.
При замыкании любого из них загорается лампочка «E1» световой сигнализации, а также через нормально замкнутый контакт K1.2 реле K1, напряжение 220 вольт подается на сирену / звонок звуковой сигнализации.
Если сигнализация включена, а нужно отключить звук, — нажатием кнопки «Съем звука», напряжение подается на катушку реле K1. При его срабатывании размыкается цепь питания сирены (контакт K1.2), звук отключается. Само же реле подхватывается через контакт K1. 1.
1.
Если контакт прибора, вызвавший включение сигнализации размыкается, то соответственно выключается сигнализация – и световая, и звуковая. Реле K1 приводится в исходное состояние.
Достоинства
Простота
Недостатки
При использовании лампочки и сирены большой мощности, через коммутационные контакты S1…Si реле приборов может проходить большой ток, что может привести к их подгоранию и выходу из строя. Поэтому, при реализации данной схемы необходимо следить за тем, чтобы суммарный ток лампочки и сирены не превышал предельно допустимый паспортный ток для выходных устройств (реле) приборов.
Буферизированная схема световой и звуковой сигнализации
Схема общей сигнализации, представленная на рисунке 2 по принципу действия соответствует схеме сигнализации представленной выше.
Рисунок 2. Буферизированная схема световой и звуковой сигнализации
Но здесь добавлено промежуточное буферное реле K1 (~220 вольт), исключающее выход из строя контактов реле выходных устройств приборов.
При замыкании контакта реле выходных устройств приборов, через катушку реле / пускателя K1 проходит сравнительно небольшой ток, в большинстве случаев не превышающий предельно-допустимый паспортный. В то же время замыкающий, силовой контакт этого реле / пускателя, может коммутировать достаточно большую мощность для подключения лампочки и сирены свето-звуковой сигнализации.
Триггерная схема световой и звуковой сигнализации
Предыдущие две схемы сигнализации работают таким образом, что при превышении каких либо уставок загорается лампочка и включается звук, а при переходе в нормальный режим, — и свет и сирена отключаются.
В некоторых случаях может быть необходимо включении сигнализации на длительное время даже при кратковременном превышении уставок технологических параметров.
Схема такой сигнализации изображена на рисунке 3.
Рисунок 3. Триггерная схема световой и звуковой сигнализации
Принцип действия аналогичен предыдущей схеме, за исключением того, что в реле K1 добавлен нормально разомкнутый контакт самоподхвата K1. 1 и кнопка сброса (выключения) сигнализации SB2.
Даже при кратковременном превышении параметра уставок приборов (замыкании контактов S1…Si), реле K1 сработает и заблокируется контактом K1.1.
Сбросить его в исходное состояние (выключить сигнализацию) можно разорвав цепь питания его катушки вручную кнопкой SB2.
Схема световой и звуковой сигнализации на реле РТД12
Схема звуковой сигнализации на реле РТД12 показана на рисунке 4.
Если предыдущие схемы идеально подходят реализации для одноканальной сигнализации, то при подключении нескольких приборов не всегда может быть удобно определять каким именно прибором вызвано включение сигнализации. Схема, приведенная ниже работает таким образом, что при срабатывании сигнализации от неограниченного числа приборов включается общая звуковая сигнализация – сирена и загорается одна или несколько лампочек, указывающая на канал (прибор, устройство) от которого сработала сигнализация.
Рисунок 4. Схема световой и звуковой сигнализации на реле РТД12
K1 – реле опробования сигнализации . Напряжение катушки = ~220 вольт.
K2 – реле включения / отключения звуковой сигнализации. Напряжение катушки = ~220 вольт.
B1 – звонок / сирена ~220 вольт.
S1…Si – контакты реле уставок приборов (может быть неограниченное количество)
E1…E2 – лампочки накаливания ~220 вольт, 10 Вт
VD1…VDi — диоды типа Д226Г или более современные, на напряжение не менее 400 вольт.
SB1, SB2 – кнопки «опробование сигнализации» и «съем звука».
R1 – резистор 2.2 кОм, мощностью не менее 10 Вт.
Особенность схемы заключается в том, что при замыкании одного из контактов реле выходных устройств приборов, фаза ~220 Вольт подается через соответствующую лампочку канала на вход реле РТД12, вызывая его включение. При этом лампочка горит и включается звуковая сигнализация.
При этом лампочка горит и включается звуковая сигнализация.
Если лампочка неисправна, то не происходит включение реле, и соответственно не сработает ни звуковая, ни световая сигнализация. Чтобы избежать этого, требуется периодически проверять работу сигнализации, исправность лампочек. Для этих целей предназначена кнопка SB1 — «опробование сигнализации». При ее нажатии срабатывает реле K1, загораются все исправные лампы сигнализации, а также включается сирена / звонок звуковой сигнализации.
Отключение звука производится кнопкой SB2 — «съем звука».
Простая сигнализация своими руками (фото + схема) | Своими руками
ДАЧА ИЛИ ГАРАЖ ЧАСТО ПРИВЛЕКАЮТ ВНИМАНИЕ ЗЛОУМЫШЛЕННИКОВ. ОБЕСПЕЧИЛ ЗАЩИТУ ЭТИХ ПОМЕЩЕНИЙ, УСТАНОВИВ ОХРАННУЮ СИГНАЛИЗАЦИЮ СОБСТВЕННОГО ИЗГОТОВЛЕНИЯ.
Понадобилось: блок с датчиком освещенности, лазерный диод, блок питания лазерного диода адаптер на 12 В.
Сборка цепи
Блок с датчиком освещенности (см.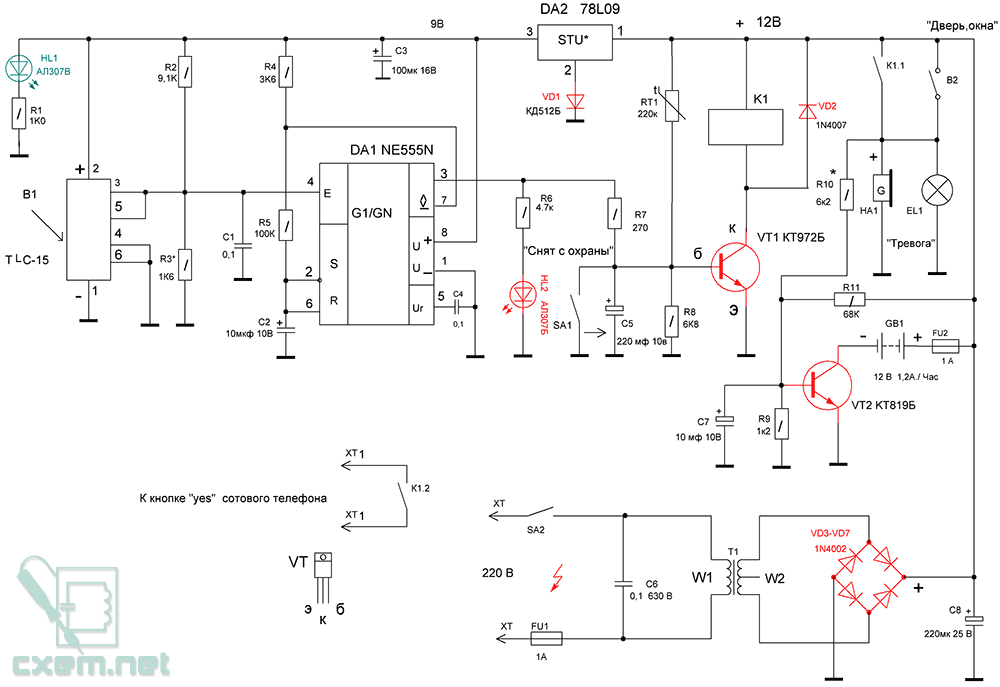 фото, п. 1) при попадании на него света лазерного диода (2) не подает сигнал. Как только луч прерывается, на блоке срабатывает реле, и включается сигнал.
фото, п. 1) при попадании на него света лазерного диода (2) не подает сигнал. Как только луч прерывается, на блоке срабатывает реле, и включается сигнал.
Чтобы он не выключился после установки луча на место, добавил в общую схему реле задержки на 12 В (см. рис.) (можно купить в магазине радиодеталей).
На выход реле подключил установленный на автодозвон мобильный телефон, который при проникновении в помещение злоумышленника подает сигнал звонком на мой номер.
Схема защиты
На одной стороне двери установил датчик, а на другой закрепил диод так, чтобы его не было видно. Если необходимо защитить все окна и двери в одном помещении, по углам надо разместить зеркала размером 5×5 см на одном уровне таким образом, чтобы луч проходил через них по периметру комнаты (см. схему)
Злоумышленник влезает в окно — цепь размыкается, и подается сигнал.
Читайте также: Монтаж системы пожарной сигнализации и пожаротушения – примеры схем и расчетов
На заметку
Можно установить эту систему на автомобиль: в двери водителя и пассажира.
Когда угонщик садится за руль, луч прерывается и сигнализация либо подает сигнал, либо размыкает один из проводов ключа зажигания.
Сигнализация своими руками – схема и фото
© Автор: Юрий Афанасьев, Эстония. Фото автора
ИНСТРУМЕНТ ДЛЯ МАСТЕРОВ И МАСТЕРИЦ, И ТОВАРЫ ДЛЯ ДОМА ОЧЕНЬ ДЕШЕВО. БЕСПЛАТНАЯ ДОСТАВКА. ЕСТЬ ОТЗЫВЫ.Ниже другие записи по теме «Как сделать своими руками — домохозяину!»
Подпишитесь на обновления в наших группах и поделитесь.
Будем друзьями!
Как сделать сигнализацию своими руками в домашних условиях?
Просмотров: 15 535
В современном мире практически невозможно обойтись без средств охраны – особенно это актуально для защиты своего недвижимого имущества от грабителей, которые постоянно усовершенствуют способы проникновения в дом, квартиру, дачу или гараж. Для таких случаев эффективными являются электронные охранные системы в виде сигнализаций. Эти барьеры безопасности минимизируют вероятность кражи и позволяют владельцу недвижимости вовремя среагировать на опасную ситуацию. На сегодняшний день множество компаний предлагают широкий выбор многофункциональных сигнализаций, а также их установку и обслуживание. В зависимости от сложности используемого охранного комплекта будет зависеть и его стоимость, которая порой может быть достаточно большой. Если владелец дома не имеет возможности приобрести и установить дорогой охранный комплект, он задумывается о том, как сделать сигнализацию своими руками. Оказывается, это не такой уж и сложный процесс – важно хоть немного разбираться в электронике и электромонтажных работах, и смастерить сигнализацию не составит большого труда.
Для таких случаев эффективными являются электронные охранные системы в виде сигнализаций. Эти барьеры безопасности минимизируют вероятность кражи и позволяют владельцу недвижимости вовремя среагировать на опасную ситуацию. На сегодняшний день множество компаний предлагают широкий выбор многофункциональных сигнализаций, а также их установку и обслуживание. В зависимости от сложности используемого охранного комплекта будет зависеть и его стоимость, которая порой может быть достаточно большой. Если владелец дома не имеет возможности приобрести и установить дорогой охранный комплект, он задумывается о том, как сделать сигнализацию своими руками. Оказывается, это не такой уж и сложный процесс – важно хоть немного разбираться в электронике и электромонтажных работах, и смастерить сигнализацию не составит большого труда.
Вариант сигнализации своими руками на дверь
Преимущества самодельной сигнализации
Несмотря на то, что самодельная сигнализация, создается в домашних условиях, она владеет целым рядом преимуществ, которые позволяют ей конкурировать с заводскими системами безопасности.
Во-первых, наиболее простая домашняя сигнализация своими руками может реализовываться даже из подручных средств, которые имеются в домашнем хозяйстве. Практически у каждого дома найдется неиспользуемый мобильник, элементы исполнительных устройств различного бытового оборудования и пр. Если чего-то и не хватает, то его можно за копейки докупить на любом радиорынке. Финансовые затраты на охранную систему, созданную в домашних условиях минимальны.
Во-вторых, сигнализация самоделка может в любой момент легко изменяться конструкционно и модернизироваться под изменившиеся условия эксплуатации на объекте. Не с каждой заводской охранной системой можно будет это сделать.
Недостатки
Каким хорошим не был бы свой проект охранной сигнализации, она не лишена недостатков. К основным из них следует отнести следующие:
- отсутствие встроенных систем защиты от различных приспособлений, которые используются злоумышленниками для отключения сигнализаций;
- невозможность подключения таких устройств к системам безопасности охранных компаний;
- самостоятельно сложно реализовать сложные охранные конфигурации, которые включают в свой состав широкий спектр охранных и функциональных датчиков, исполнительных устройств;
- самодельная простая сигнализация не поддерживает возможность ведения аудио- и видеоконтроля с охраняемого объекта;
- без базовых знаний электроники сделать собственную охранную систему не получится.

Какие виды сигнализации можно сделать своими руками?
В домашних условиях самостоятельно можно реализовать несколько вариантов охранных систем, которые позволят решить конкретные задачи по защите недвижимости.
- Сигнализация на основе датчика движения
Простая сигнализация в квартиру своими руками может создаваться на основе обычного датчика движения, которым комплектуются осветительные системы, устанавливаемые в подъездах и на лестничных площадках. Если к такому датчику вместо осветительного элемента подключить сирену, то получится элементарная охранная система, которая звуковым сигналом будет предупреждать о том, что в охраняемой зоне кто-то находится.
Сигнализация на основе датчика движения с аккумулятором
- Сигнализация на основе готовых комплектов
Для тех, кто не хочет «ломать голову» как сделать самодельную сигнализацию и какие для этого устройства использовать, можно воспользоваться готовыми комплектами, которые продаются на каждом радиорынке. Нужно будет только составить схему охраняемых зон и приобрести для этого соответствующие датчики и исполнительные устройства. В дальнейшем придется выполнить монтаж купленных элементов и настроить их на выполнение соответствующих функций охраны.
Нужно будет только составить схему охраняемых зон и приобрести для этого соответствующие датчики и исполнительные устройства. В дальнейшем придется выполнить монтаж купленных элементов и настроить их на выполнение соответствующих функций охраны.
- Сигнализация на основе магнитоконтактных датчиков
Для тех, кто задумывается о том, как сделать сигнализацию в домашних условиях, которая будет реагировать на вскрытие дверей и окон вариант на магнитоконтактных датчиках будет оптимальным решением. Отличительной особенность таких датчиков является то, что они включают в свой состав два элемента – собственно основу датчика и магнит, которые должны пребывать в прямом контакте. Как только этот контакт будет нарушен, произойдет срабатывание подключенного к датчику светозвукового устройства.
Схема сигнализации на основе магнитоконтактных датчиков
Используя старый неиспользуемый мобильник, может быть создана высокоэффективная самодельная охранная сигнализация, использующая возможности GSM-связи. С помощью такой охранной системы можно будет не только приводить в действие подключенные к ней исполнительные устройства, а также оповещать владельца дома об опасности через канал мобильной связи, посылая на его мобильное устройство СМС-сообщение или осуществляя дозвон.
С помощью такой охранной системы можно будет не только приводить в действие подключенные к ней исполнительные устройства, а также оповещать владельца дома об опасности через канал мобильной связи, посылая на его мобильное устройство СМС-сообщение или осуществляя дозвон.
Схема сигнализации на основе мобильного телефона
Для тех, кто не знает, как сделать сигнализацию своими руками и временно не может позволить приобрести готовую, может установить имитатор наличия охранной системы. Для реализации элементарной схемы имитатора сигнализации потребуется всего лишь светодиодный индикатор, две пальчиковые батарейки, токоограничивающий резистор и корпус для расположения перечисленных элементов. Свечение светодиода будет свидетельствовать о том, что объект пребывает на охране – это должно отпугивать воров. Но длительное время полагаться на охрану с помощью такого муляжа не стоить – лучше разобраться, как сделать сигнализацию своими руками или приобрести ее в магазине.
Схема муляжа на основе светодиода
Оборудование для сбора сигнализации в домашних условиях
Простая сигнализация для дома может быть построена с применением следующего комплекта устройств:
- набор датчиков – для простой охранной системы это могут быть устройства контроля движения на объекте, а также датчики открытия;
- сирена и светоизлучающие устройства – они будут сигнализировать о срабатывании охранного датчика;
- обычный выключатель – применяется для отключения сигнализации;
- автономные источники питания – это могут быть аккумуляторы или батарейки, которые будут поддерживать функционирование сигнализации при отсутствии питания во внешней сети;
- мобильный телефон – нужен в том случае, когда создается охранная сигнализация для дома с функцией оповещения владельца на его мобильные устройства;
- набор инструментов, для монтажных работ, проводники, монтажные элементы – с их помощью будет осуществлена сборка и монтаж сигнализации в домашних условиях.

Процесс создания сигнализации
Начало работ по разработке собственной охранной системы должно начинаться из создания проекта будущей сигнализации. Именно от него будет зависеть, как сделать сигнализацию дома, чтобы она обеспечивала защиту всех потенциально опасных зон. После составления детального плана следует позаботиться о наличии требуемых устройств и деталей, некоторые из них могут быть дома, а кое-какие придется докупить.
На начальном этапе производится установка соответствующих датчиков по периметру объекта, как это было запланировано в проекте.
Обратите внимание!
Чтобы при их срабатывании охранная сигнализация выполняла свои функции, к датчикам подключаются исполнительные устройства и механизмы.
Они могут подключаться через специально подготовленную схему, которая включает в свой состав электронный таймер задержки включения и коммутационные реле. В таком случае охранная система своими руками будет срабатывать не сразу, а через установленный промежуток времени, который нужен для того, чтобы владелец квартиры мог снять ее с охраны.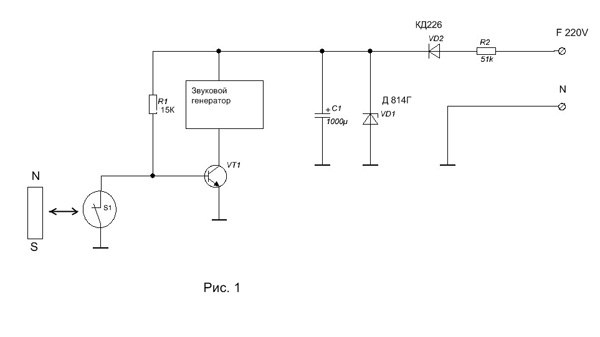 Для этой процедуры нужно установить обычный кнопочный выключатель, который нужно располагать в срытом месте, чтобы вор не смог самостоятельно отключить охрану до включения сирены.
Для этой процедуры нужно установить обычный кнопочный выключатель, который нужно располагать в срытом месте, чтобы вор не смог самостоятельно отключить охрану до включения сирены.
Один вариант создания сигнализации своими руками:
Если сигнализация своими руками создается для оповещения через сотовую сеть, то подключение датчиков должно проводиться через мобильный телефон, который параллельно со срабатыванием сирены будет посылать сигнал тревоги владельцу.
Почему выгодно использовать самодельную сигнализацию?
Проектируя и создавая сигнализацию своими руками, пользователь максимально адаптирует ее к конкретным условиям эксплуатации в своем доме, а также под решаемые охранной системой задачи. Не каждая готовая сигнализация из комплекта может оптимально подходить к конкретным условиям, а модернизировать ее не всегда получается.
Не каждая готовая сигнализация из комплекта может оптимально подходить к конкретным условиям, а модернизировать ее не всегда получается.
Выводы
Самая простая сигнализация своими руками может быть создана за достаточно короткое время с минимальными финансовыми затратами. Зато защитный эффект, который она обеспечивает, является достаточно высоким. Это гарантирует владельцу уверенность в том, что его имуществу ничего не грозит.
Как сделать простую охранную сигнализацию своими руками
Дача, отдельно стоящие хозяйственные постройки во дворе частного дома также могут стать объектом посягательств воров.Устанавливать в них промышленную охранную систему нецелесообразно, она будет стоить дороже, чем все вещи, хранящиеся в таких помещениях.
Но и оставлять совсем без защиты не стоит, любители поживиться за чужой счет если и не унесут ваше имущество, то причинят вред конструкции строении, на восстановление которых потребуются средства. Поэтому многие считают, что идеальным решением станет простая охранная сигнализация, своими руками ее может сделать практически каждый.
Содержание:
- Немного о системе охраны
- Самодельные системы и их виды
- Проект сигнализации — нужен или нет?
- Схемы на реле времени
- Все за и против самодельных систем охраны
Что входит в такую систему?
Обычно в таких моделях используют ИК датчик движения, сирену и другие комплектующие для сборки устройства. Но так как проводные извещатели рассчитаны на работу от сети в 220 В, то его придется модернизировать и перевести на 12 В. Для этого в схему добавляется реле на 6 В. Питание подается на датчик через выключатель. При срабатывании устройства напряжение поступает на обмотку реле, оно срабатывает и приводит к включению сирены.
При необходимости к такой схеме может быть подключено до нескольких устройств подачи звукового сигнала. Наличие в датчике регулятора позволяет выставлять время подачи сигнала после срабатывания сирены, обычно оно составляет не более 10 секунд. Выключается схема при помощи специального устройства, которое коммутируется ключом.
Рассмотренная простая охранная сигнализация одна из самых примитивных, она легко собирается своими руками и является экономной в плане расхода электроэнергии. Например, на зиму потребуется не более 16 щелочных батареек. Работает такая схема в любых условиях и способна выдерживать даже отрицательные температуры, так что вполне подходит для установки на неотапливаемой дач.
Виды самодельных схем
Сборка и установка системы собственными руками имеет ряд преимуществ. Она позволяет сэкономить средства, исключает возможность пособничества сотрудников компании, занимающейся установкой, ворам. Но самое главное в процессе изготовления и монтажа вы тщательно изучите структуру сигнализации, сможете сами устранять неполадки, вносить коррективы в нее, подключая дополнительные датчики и усовершенствовать свою разработку.
Смотрим видео, самодельная система охраны:
Существует несколько способов оборудования дома простой охранной сигнализацией, собранной и установленной своими руками. Первый и самый простой, но в то же время наиболее дорогостоящий – пригласить сотрудников специальной компании, которые разработают проект, подберут необходимое оборудование, установят его и выполнят пуско-наладочные работы. Этот вариант подходит для жилых и складских помещений, но непригоден для дачи, так как затраты будут превышать стоимость хранящегося там имущества.
Первый и самый простой, но в то же время наиболее дорогостоящий – пригласить сотрудников специальной компании, которые разработают проект, подберут необходимое оборудование, установят его и выполнят пуско-наладочные работы. Этот вариант подходит для жилых и складских помещений, но непригоден для дачи, так как затраты будут превышать стоимость хранящегося там имущества.
Еще один способ – купить оборудование, внимательно изучить инструкцию по его установке и эксплуатации, и выполнить монтаж самостоятельно. В общем ничего невыполнимого в таком подходе нет.
Тем более, что многие торговые фирмы занимаются программированием ПКП, что избавит вас от необходимости приобретения программатора, изучения правил работы с ним и попыток выполнить этот этап работ без посторонней помощи.
Для самого простого варианта сигнализации требуется запрограммировать шлейфы прибора, включить их в общую сеть и записать в память требуемое число ключей для доступа. Они потребуются для снятия и постановки объекта на охрану. Кроме этого программируется включение светового устройства, причем с ограничением времени работы до 10-20 минут и релейного выхода для дозвона на мобильный.
Кроме этого программируется включение светового устройства, причем с ограничением времени работы до 10-20 минут и релейного выхода для дозвона на мобильный.
Cмотрим видео, дополнение к основной сигнализации с помощью мобильного телефона;
На рынке можно найти немало GSM модулей для подачи сигнала на указанный номер при замыкании контактов на одном из входов. Эти приборы универсальны и могут подключаться к любому ПКП.
Если вы уже выбрали датчики охранной сигнализации, то далее идет их подключение к запрограммированному прибору, что достаточно легко выполнить каждому, кто в состоянии найти «плюс» и «минус» в схеме. Опять же при самостоятельно произведенном монтаже вы сможете детально разобраться с прокладкой кабелей и в случае поломки устраните ее без проблем.
Смотрим видео о покупной системе GSM:
Для тех, кого проводная система не устраивает можно выбрать беспроводной вариант.
У извещателей также есть свои плюсы. Они могут переносится с одного места в другое, при необходимости, без особых хлопот. Рассмотренный выше вариант можно удешевить, купив оборудование бывшее в употреблении. Этот вариант может использоваться как охранная сигнализация для гаража и легко собирается своими руками.
Еще один, самый дешевый, но и малоэффективный способ – установка муляжей. Такая система вряд ли сможет испугать матерого вора, но вот мальчишек, решивших пошалить на чужой даче остановить сможет.
Проект для самодельной сигнализации – нужен или нет?
Решив установить в доме охранную систему первым приходится решать вопрос с разработкой и оформлением документации. Профессионально выполненный проект является основой для будущей системы, если ее монтаж будет осуществляться сотрудниками специальной компании. А как быть тем, кто решил выполнить все работы самостоятельно?
А как быть тем, кто решил выполнить все работы самостоятельно?
Если вы устанавливаете сигнализацию в общественном месте, то проект должен быть обязательно, иначе надзорные службы систему не примут. Но дом к таким объектам не относится, поэтому для установки в нем оборудования потребуется только схема датчиков, которая необходима для будущего обслуживания.
Простейшие схемы – на реле времени
Мы рассмотрим только две из них. Первая охранная сигнализация для дома, которую можно собрать своими руками строится на реле времени. Оно имеет две группы контактов, причем одна срабатывает мгновенно, а вторая через 5-10 секунд. Это необходимо для того, чтобы владелец объекта при входе в него успел выключить систему специальной кнопкой, которую устанавливают в скрытом месте.
Полное же отключение выполняется специальным тумблером. При такой конструкции на коробке двери устанавливается датчик положения. Перед входом производят монтаж кнопки, включающей схему в режим охрана, после выхода владельца. Обычно в таких комплексах используется реле на 12 или 24 В.
Обычно в таких комплексах используется реле на 12 или 24 В.
Смотрим видео, дополнение к GSM сигнализации, реле 12 В:
Недостатком схемы является звучание сирены до момента выключения сигнализации кнопкой. Для его устранения система дополняется еще одним реле время срабатывания контактов в котором не превышает 120-180 сек. По истечении данного промежутка сирена отключается и находится в таком положении до включения режима охраны.
Вторая из предлагаемых к реализации схем охранной сигнализации, собираемой своими руками,основана на одном реле. Время работы сирены в ней задается при помощи реле. А в ждущий режим она переходит после обесточивания системы. В этой схеме применяется тиристор, обеспечивающий пожарную и электрическую безопасность оборудования.
Оно рассчитана на подключение большого числа датчиков различного назначения. Например, для стекол можно использовать извещатели в виде полосок металлической фольги, срабатывающие при их разбивании. Их соединение в общую сеть выполняют последовательно.
Их соединение в общую сеть выполняют последовательно.
Возможно использование и другого вида тиристоров. Например, модель ПЭВ-10 мощностью до 10 Вт или несколько с меньшим номиналом.
При разрыве цепи сработает реле, что приведет к включению сирены или любого мощного звонка. Дополнительно в схему может включаться лампочка, являющаяся вспомогательным элементом, не влияющим на работу системы.
Надежен ли такой способ охраны?
Защита имущества в наше время становится самым актуальным вопросом. И способ его решения зависит от многих факторов, но часто решающим среди них становится стоимость.
Не имеет смысла устанавливать сигнализацию, цена которой превышает ценность охраняемого имущества. Для таких случаев идеальным решением является разработка и установка системы самостоятельно.
Но будет ли такая сигнализация эффективной? В некоторых случаях она конечно сможет отпугнуть воров, но для надежной охраны лучше воспользоваться профессиональным оборудованием и услугами специалистов. Применение пультовой охраны станет не только надежной охраной, но и позволит вернуть средства, если все же ограбление будет совершено.
Применение пультовой охраны станет не только надежной охраной, но и позволит вернуть средства, если все же ограбление будет совершено.
Разработка индивидуальных сигнальных схем для клеток
Nat Rev Mol Cell Biol. Авторская рукопись; доступно в PMC 2010 8 ноября.
Опубликован в окончательной отредактированной форме как:
PMCID: PMC2975372
NIHMSID: NIHMS246517
Венделл А. Лим
HHMI и Отдел клеточной и молекулярной фармакологии UCS Propulsion Lab, Центр разработки наномедицины NIH, Исследовательский центр синтетической биологии NSF
Wendell A.Лим, HHMI и отдел клеточной и молекулярной фармакологии, UCSF, Лаборатория движения клеток, Центр разработки наномедицины NIH, Исследовательский центр инженерной синтетической биологии NSF;
См. Другие статьи в PMC, в которых цитируется опубликованная статья.Abstract
Живые клетки развили широкий спектр сложных сигнальных реакций, которые позволяют им выживать в различных условиях окружающей среды и выполнять определенные физиологические функции. Наше все более сложное понимание молекулярных механизмов клеточных сигнальных сетей у эукариот выявило удивительно модульную организацию, и синтетические биологи изучают, как это можно использовать для создания клеток с новым сигнальным поведением.Этот подход начинает раскрывать логику того, как клетки могут развивать инновационные новые функции, и подталкивает нас к захватывающей возможности создания пользовательских клеток с точными функциями восприятия и реакции, которые могут быть полезны в медицине и биотехнологии.
Наше все более сложное понимание молекулярных механизмов клеточных сигнальных сетей у эукариот выявило удивительно модульную организацию, и синтетические биологи изучают, как это можно использовать для создания клеток с новым сигнальным поведением.Этот подход начинает раскрывать логику того, как клетки могут развивать инновационные новые функции, и подталкивает нас к захватывающей возможности создания пользовательских клеток с точными функциями восприятия и реакции, которые могут быть полезны в медицине и биотехнологии.
Ключевые слова: передача сигналов клеток, инженерия, синтетическая биология, терапевтический, MAP-киназа, каркас, модули, белковые взаимодействия, N-WASP, рецепторы, GPCR, Notch, RTK, рак, адоптивная иммунотерапия, химерные антигенные рецепторы, Т-клетки. , оптический контроль, биопродукция
Живые клетки — это высокодинамичные системы, которые используют сложные молекулярные сигнальные цепи для мониторинга внешнего и внутреннего состояния и выполнения соответствующих физиологических реакций. Как и любая сенсорная машина, созданная или созданная человеком, эти клеточные сигнальные цепи содержат подсистемы принятия решений, которые действуют как сенсоры и процессоры (например, рецепторы и их последующие эффекторы), которые в конечном итоге контролируют различные подсистемы ответа (такие как транскрипция генов и динамика цитоскелета) ( ). Основная цель современной клеточной биологии — понять, как эти молекулярные сигнальные системы достигают своих сложных ответов, которые оптимально настроены для их физиологической роли. Хотя подавляющее большинство исследований нацелено на анализ, картирование и анализ сигнальных сетей клеток, наше растущее понимание того, как работают эти системы, привело к появлению радикально нового подхода — усилий по разработке и созданию собственных синтетических сигнальных цепей [1,2 ].
Как и любая сенсорная машина, созданная или созданная человеком, эти клеточные сигнальные цепи содержат подсистемы принятия решений, которые действуют как сенсоры и процессоры (например, рецепторы и их последующие эффекторы), которые в конечном итоге контролируют различные подсистемы ответа (такие как транскрипция генов и динамика цитоскелета) ( ). Основная цель современной клеточной биологии — понять, как эти молекулярные сигнальные системы достигают своих сложных ответов, которые оптимально настроены для их физиологической роли. Хотя подавляющее большинство исследований нацелено на анализ, картирование и анализ сигнальных сетей клеток, наше растущее понимание того, как работают эти системы, привело к появлению радикально нового подхода — усилий по разработке и созданию собственных синтетических сигнальных цепей [1,2 ].
a | Клетки обычно воспринимают стимулы окружающей среды через рецепторы и другие датчики . Затем эта информация обрабатывается внутриклеточными сигнальными сетями, которые, в свою очередь, задействуют различные клеточные продукты, включая экспрессию генов, секрецию, изменения цитоскелета и рост клеток.
Затем эта информация обрабатывается внутриклеточными сигнальными сетями, которые, в свою очередь, задействуют различные клеточные продукты, включая экспрессию генов, секрецию, изменения цитоскелета и рост клеток.
b | Некоторые из основных проблем в развитии или разработке новых сигнальных цепей: : достижение правильной связи определенных входов и конкретных выходов; настройка количественного поведения сигнального ответа — доза-реакция и динамика — так, чтобы они были оптимальными для физиологической функции; и создание устойчивых пространственно самоорганизующихся процессов, таких как процессы, связанные с поляризацией клеток, направленной подвижностью, делением клеток и компартментализацией клеток.
Здесь мы сосредоточимся на синтетической биологии передачи сигналов и посмотрим, как можно спроектировать сигнальные схемы эукариотических клеток для создания клеток с заданным поведением передачи сигналов. Эукариотические клетки используют сети сигнальных белков, чтобы ощущать окружающую их среду и обеспечивать быстрые ответы. Поскольку сети обработки сигналов в клетках функционируют в трехмерном пространстве, они также контролируют сложные пространственные или морфологические клеточные реакции. Мы рассмотрим, как могут быть созданы сигнальные цепи с точным поведением реакции, учитывая, как определяется специфичность ответа (то есть, какие наборы выходных сигналов связаны с конкретным входом), как точно настроенная доза-реакция или временная динамика профили ответов оптимизированы для конкретных физиологических функций и того, как можно достичь сложного пространственного и морфологического контроля ().Мы также рассмотрим, почему появились усилия по разработке и созданию специализированных синтетических сигнальных цепей, как они могут обеспечить более глубокое видение принципов и механизмов разработки молекулярных сигнальных систем и как индивидуализированные реакции на поведение могут быть применены в медицине и биотехнологии. Наконец, мы рассматриваем, как в будущем могут быть разработаны инструменты и методы, которые упростят разработку клеточного поведения.
Поскольку сети обработки сигналов в клетках функционируют в трехмерном пространстве, они также контролируют сложные пространственные или морфологические клеточные реакции. Мы рассмотрим, как могут быть созданы сигнальные цепи с точным поведением реакции, учитывая, как определяется специфичность ответа (то есть, какие наборы выходных сигналов связаны с конкретным входом), как точно настроенная доза-реакция или временная динамика профили ответов оптимизированы для конкретных физиологических функций и того, как можно достичь сложного пространственного и морфологического контроля ().Мы также рассмотрим, почему появились усилия по разработке и созданию специализированных синтетических сигнальных цепей, как они могут обеспечить более глубокое видение принципов и механизмов разработки молекулярных сигнальных систем и как индивидуализированные реакции на поведение могут быть применены в медицине и биотехнологии. Наконец, мы рассматриваем, как в будущем могут быть разработаны инструменты и методы, которые упростят разработку клеточного поведения.
Почему инженерная сигнализация ячейки?
Прежде чем рассматривать конкретные примеры сконструированных сигнальных путей, полезно обсудить мотивацию инженерии клеточной сигнализации.Попытка создать новое сигнальное поведение в клетках может показаться смелой и глупой целью, учитывая, что у нас еще нет полного или надежного предсказательного понимания естественных сигнальных цепей клеток. Однако разработка клеточной сигнализации — это не просто процесс применения уже хорошо разработанного понимания, но она предлагает подход к «пониманию через построение». В то время как биология традиционно была наукой анализа и деконструкции для выявления генов и молекул, которые важны для конкретного процесса, синтетическая биология предлагает обратный подход, фокусируясь на том, как отдельные молекулярные части могут быть собраны в системы, которые выполняют сложное поведение.Поскольку в настоящее время у нас есть полностью секвенированные геномы и огромное количество протеомных данных, нам не хватает не полного списка молекулярных частей, а скорее понимания того, как эти части сочетаются друг с другом функционально согласованным образом. Разработка новых сигнальных сетей клеток предлагает нам подход к тестированию и расширению нашего понимания принципов организации сложных молекулярных систем.
Разработка новых сигнальных сетей клеток предлагает нам подход к тестированию и расширению нашего понимания принципов организации сложных молекулярных систем.
В этом смысле синтетическая биология передачи сигналов не просто ориентирована на достижение цели приложения, такой как построение клетки с целевой функцией, но также является исследовательской наукой, в которой важно понимать, какие конструкции «работают». и как они соотносятся с «неработающими» дизайнами.Если, например, у кого-то есть естественная сигнальная сеть, которая выполняет сложное представляющее интерес поведение, традиционная генетическая деконструкция может использоваться для идентификации молекул и связей, которые необходимы и важны для функции (). Однако затем можно использовать синтетические подходы для систематического изучения многих типов изменений — альтернативных сетевых связей, настройки силы связей, добавления новых связей — для проверки того, какие сети совместимы с этим интересующим поведением. Анализируя естественную сеть или проектируя единственную успешную схему, вряд ли можно получить более глубокое понимание функционального ландшафта, которое может дать более полное и систематическое исследование синтетической схемы () [3–5]. В этом смысле попытки спроектировать клеточное поведение сродни ранней истории синтетической органической химии, где синтез новых или модифицированных молекул обеспечил дополнительный подход к химическому анализу в развитии фундаментальных теорий химической связи, структуры и реакционной способности [ 6]
В этом смысле попытки спроектировать клеточное поведение сродни ранней истории синтетической органической химии, где синтез новых или модифицированных молекул обеспечил дополнительный подход к химическому анализу в развитии фундаментальных теорий химической связи, структуры и реакционной способности [ 6]
и | понимание принципов дизайна. Традиционно для анализа сигнальной сети используются такие методы, как нарушение гена.Синтетические подходы предлагают дополнительную информацию, создавая альтернативные версии сети, которые различаются как подключением к сети, так и мощностью каналов. Сопоставляя пространство функциональных (красные кружки) и нефункциональных (синие кружки) вариантов, можно получить более глубокое понимание функциональных требований.
b | конструирует дизайнерские сигнальные пути для терапевтических или биотехнологических приложений. Мы надеемся собрать набор сигнальных модулей, которые можно использовать для создания ячеек со спроектированными сигнальными ответами.Противораковая клетка может обнаруживать комбинацию сигналов опухоли и давать такие ответы, как выработка реагентов для визуализации, уничтожение клеток или секреция факторов, нарушающих микросреду опухоли. Такая ячейка может также иметь предохранительные выключатели, которые могли бы отключить ячейку при необходимости. Иммуносупрессивная клетка может обнаруживать комбинацию аутоиммунного ответа или сигналов отторжения трансплантата и запускать локальные контрмеры, такие как секреция противовоспалительных цитокинов. Интеллектуальная биопродуктивная (ферментационная) клетка будет спроектирована так, чтобы точно модулировать поток роста по сравнению с производственными путями в ответ на стрессовое состояние клетки, тем самым оптимизируя общий урожай.
Мы надеемся собрать набор сигнальных модулей, которые можно использовать для создания ячеек со спроектированными сигнальными ответами.Противораковая клетка может обнаруживать комбинацию сигналов опухоли и давать такие ответы, как выработка реагентов для визуализации, уничтожение клеток или секреция факторов, нарушающих микросреду опухоли. Такая ячейка может также иметь предохранительные выключатели, которые могли бы отключить ячейку при необходимости. Иммуносупрессивная клетка может обнаруживать комбинацию аутоиммунного ответа или сигналов отторжения трансплантата и запускать локальные контрмеры, такие как секреция противовоспалительных цитокинов. Интеллектуальная биопродуктивная (ферментационная) клетка будет спроектирована так, чтобы точно модулировать поток роста по сравнению с производственными путями в ответ на стрессовое состояние клетки, тем самым оптимизируя общий урожай.
Изучение пластичности сигнальных путей и того, как их функции могут быть настроены, также имеет отношение к патологии и лечению заболеваний. Многие виды рака обладают онкогенными мутациями, которые эффективно «переплетают» сигнальные сети клеток, контролирующие баланс между ростом, дифференцировкой и гибелью клеток [7]. Точно так же многие внутриклеточные патогены, включая бактерии и вирусы, производят специфические белки, которые «переплетают» эндогенные сигнальные пути [7]. 8–10]. Многие белки бактериальных патогенов, которые взаимодействуют с клеточной сигнальной киназой и путями регуляции актина, часто для подавления иммунного ответа хозяина или усиления инфекции (см. Дополнительную вставку 1).Таким образом, используя синтетическую биологию для понимания пластичности путей и того, как их поведение изменяется из-за сетевых возмущений, мы можем получить лучшую основу для понимания стратегий, которые патоген принимает для использования внутренней уязвимости сигнальных сетей. Более того, мы можем разработать стратегии для возврата больной сети к стабильному, непатологическому поведению. Наиболее стабильные методы лечения на основе сети могут включать не просто блокировку первичного онкогенного белка лекарством, а изменение структуры сети таким образом, чтобы она располагалась в новой и стабильной области поведенческого пространства.
Многие виды рака обладают онкогенными мутациями, которые эффективно «переплетают» сигнальные сети клеток, контролирующие баланс между ростом, дифференцировкой и гибелью клеток [7]. Точно так же многие внутриклеточные патогены, включая бактерии и вирусы, производят специфические белки, которые «переплетают» эндогенные сигнальные пути [7]. 8–10]. Многие белки бактериальных патогенов, которые взаимодействуют с клеточной сигнальной киназой и путями регуляции актина, часто для подавления иммунного ответа хозяина или усиления инфекции (см. Дополнительную вставку 1).Таким образом, используя синтетическую биологию для понимания пластичности путей и того, как их поведение изменяется из-за сетевых возмущений, мы можем получить лучшую основу для понимания стратегий, которые патоген принимает для использования внутренней уязвимости сигнальных сетей. Более того, мы можем разработать стратегии для возврата больной сети к стабильному, непатологическому поведению. Наиболее стабильные методы лечения на основе сети могут включать не просто блокировку первичного онкогенного белка лекарством, а изменение структуры сети таким образом, чтобы она располагалась в новой и стабильной области поведенческого пространства.
Применение инженерной передачи сигналов в терапии и биотехнологии
Еще одним мотивом для разработки сигнального поведения клеток является возможность конструирования клеток, запрограммированных для выполнения точно разработанных приложений (). Представьте себе, если бы мы могли имитировать и превзойти эволюцию, используя набор молекулярных компонентов для генетической инженерии клеток, которые выполняют индивидуально разработанные реакции. По мере развития биологии стволовых клеток [11–12] и развития таких методов, как адоптивная иммунотерапия [13–14], возможность использования клеточной терапии становится все ближе, но это потребует сложной клеточной инженерии для точного контроля поведения клеток.Например, без нового контроля, как может быть направлена правильная миграция и дифференцировка стволовых клеток для регенеративной медицины при отсутствии нормальных сигналов развития? Более того, по мере того, как все больше промышленных производственных процессов задействуют биологические организмы (такие как производство биотоплива или материалов) [15], может появиться возможность разработать более разумные производственные штаммы, которые, как и макроскопические производственные объекты, будут иметь системы клеточного контроля, которые отслеживают внешние и внутренние состояния для оптимизации производство.Это может быть особенно важно, поскольку мы просим ферментирующие организмы, такие как дрожжи, производить широкий спектр материалов, которые могут оказывать токсическое действие.
Разработанные противораковые клетки
Если мы сосредоточимся на разработке индивидуальных терапевтических клеток, которые могут воспринимать сигналы болезни и выполнять целенаправленные и точно откалиброванные терапевтические программы, какое поведение мы хотели бы? Иммунные клетки, такие как Т-лимфоциты или естественные клетки-киллеры, можно модифицировать для идентификации и уничтожения опухолевых клеток.Такие клетки уже можно удалить у пациентов, генетически модифицировать, размножить ex vivo и адаптивно перенести обратно пациенту [16-17]. Противораковая клетка может быть разработана для обнаружения комбинации сигналов, связанных с опухолью, включая специфические опухолевые антигены, гипоксию, органоспецифические антигены, а также специфические факторы роста и цитокины, которые секретируются опухолями, чтобы избежать нормальных иммунных ответов и создать микроокружение, способствующее развитию опухолей [18],. Инженерные клетки, которые распознают эти факторы, но связаны с противоопухолевым ответом, были бы идеальными.Также критически важно разработать внешний контроль (например, небольшую молекулу) или предохранительные переключатели для этих терапевтических клеток, чтобы их поведение можно было отключить или ослабить в ответ на нежелательные побочные эффекты, или чтобы титровать величину их реакции.
Сконструированные клетки, которые обнаруживают эти специфические для опухоли входные данные, могут быть сконструированы для получения ряда различных ответов, таких как производство агентов визуализации, которые помогают в идентификации опухолей и метастазов, и контроль эндогенных иммунных клеточных реакций, таких как хемотаксис, фагоцитоз и убийство клеток.Возможно, наиболее важно то, что эти терапевтические клетки могут быть запрограммированы на секретирование факторов, нарушающих локальное микроокружение опухоли, таких как провоспалительные цитокины и факторы антиангиогенеза, что делает их непригодными для устойчивого роста опухоли. Это было бы эквивалентно созданию специальной иммунной клетки, которая выводит из строя опухолевые клетки и микроокружение на нескольких уровнях.
Направленная иммуносупрессия
Иммунная клетка также может быть разработана для блокирования аутоиммунного заболевания или отторжения трансплантированных органов.Обычная иммуносупрессивная лекарственная терапия имеет широкие и серьезные системные эффекты. Сконструированная клетка может быть запрограммирована на местную иммуносупрессивную реакцию, возможно, в ответ на специфические аутоиммунные антигены или антигены трансплантата в сочетании с цитокиновыми сигнатурами сильного аутоиммунного ответа. Такие клетки могут быть запрограммированы на хемотаксис к участкам этих сигналов и реагировать путем секреции противовоспалительных цитокинов, которые отключили бы воспалительные петли положительной обратной связи, которые обычно приводили бы к полномасштабной аутоиммунной реакции или реакции отторжения.
Хотя индивидуально разработанные терапевтические клетки — это будущее, полезно подумать о том, какое поведение обнаружения и реакции будет ценным, так как они обеспечивают полезные целевые вехи в разработке инструментов и стратегий для перестройки клеток.
Можно ли проектировать сети передачи сигналов сотовой связи?
Существуют большие разногласия относительно того, действительно ли элементы можно спроектировать. Системы клеточной сигнализации настолько тонко оптимизированы, что наше вмешательство приведет к катастрофическим сбоям, или настолько надежно спроектированы эволюцией, что добавление новых генов и сетевых связей не сможет существенно изменить функцию? Очевидно, что эволюция смогла перестроить клеточные сигнальные пути, чтобы получить разнообразные ответы — на определенном уровне они относительно пластичны и эволюционируют.Таким образом, прежде чем пытаться создать новое клеточное поведение, может быть поучительно подумать о том, как эволюция может достичь инновационных новых функций.
Отличительной чертой сигнальных белков, которая, как полагают, играет важную роль в эволюции, является их модульная структура. Они почти всегда состоят из множества модульных доменов, некоторые из которых выполняют каталитическую функцию, а многие — специфические регуляторные функции или функции взаимодействия [19, 20]. Эти модульные домены встречаются в различных сигнальных белках в самых разных комбинациях.Это привело к модели, согласно которой разнообразие сигнальных функций может развиваться посредством рекомбинации этого набора доменов. Таким образом, в принципе, если бы мы могли понять, как эволюция работает с этими модулями, мы могли бы использовать тот же набор инструментов, чтобы найти области пространства поведения, которые эволюция, насколько нам известно, еще не исследовала.
Почему сигнальные белки и системы настолько модульны? Большинство согласны с тем, что в эволюционной временной шкале организмы находятся под давлением приспособленности к развитию инновационных клеточных сигнальных реакций, которые могут привести к преимуществам в изменяющейся окружающей среде и по сравнению с конкурирующими организмами.Под воздействием такого рода изменяющегося давления приспособленности модульные системы могут спонтанно развиваться как способ облегчить более быструю диверсификацию функций [21]. Алон и его сотрудники смоделировали эволюцию биологической сети, используя эволюционные алгоритмы для поиска простых вычислительных сетей, которые решают поставленную цель [22]. Когда они неоднократно меняют целевую цель, результирующие сети спонтанно развивают более модульные решения — сети, которые имеют внутри себя функциональные подсети. Эти заранее сформированные подсети — модули — могут быть быстро переподключены новыми способами для перехода от одной целевой функции к другой.По сути, кажется, что модули предоставляют способ быстро перемещаться из одного функционального пространства в другое, перепрыгивая через обширные области нефункционального сетевого пространства. Таким образом, модульная организация сигнальных белков и сетей может отражать давление на эти системы с целью создания поведения, которое соответствует потребностям постоянно меняющейся среды.
Важность модульности в облегчении эволюции новых функций согласуется с концепциями эволюции и развития, в которых утверждается, что большая часть диверсификации функций и морфологии организмов эволюционирует через альтернативное регулирование существующих компонентов, а не на изобретение принципиально новых компонентов [23].Хотя многие из этих идей были разработаны с упором в первую очередь на регуляцию генов с помощью различных цис-действующих модулей, они также могут применяться к регуляции ключевых каталитических сигнальных модулей с помощью разнообразных локализационных и регуляторных модулей [24,25]. Неудивительно, что многие из усилий по разработке нового сигнального поведения, описанного ниже, используют стратегии рекомбинации модульных функциональных единиц новыми способами, таким образом, по сути, используя эволюционную стратегию для создания новой функции.
Разработка новых сенсорных систем
Одним из наиболее важных инструментов для изменения поведения клеток будет способность создавать новые датчики и рецепторы для целевых входов.Однако это, пожалуй, наименее охарактеризованный элемент в инженерии клеточной сигнализации, потому что вселенная возможных входов настолько обширна и часто включает проблему работы с относительно сложными мембранно-ассоциированными мембранными белками. Ниже мы описываем недавний прогресс в модификации или конструировании различных рецепторных молекул.
Перенаправление выхода естественных рецепторов
Природные рецепторы, которые обнаруживают специфические эндогенные входы, могут быть спроектированы для генерации неродной выходной реакции.Есть несколько примеров перенаправления нативного рецептора, чтобы вызвать новый транскрипционный ответ. Один из таких подходов использует модульную структуру рецепторного белка Notch. Notch — это трансмембранный рецептор, который обнаруживает белок Delta, присутствующий на соседних клетках, — критический канал межклеточной коммуникации в развитии и дифференцировке. Когда Delta связывает Notch, трансмембранная область Notch расщепляется мембранной протеазой, высвобождая C-концевой домен Notch в цитоплазму.Этот домен может проникать в ядро и активировать транскрипцию гена. Struhl et al. Показали, что этот модуль фактора транскрипции рецептора notch может быть заменен синтетическим фактором транскрипции (Gal4-AD), так что при активации in vivo этот химерный рецептор notch может активировать гены, нацеленные на новый фактор транскрипции [26 , 27]. Хотя эту конструкцию использовали в качестве репортера для активации Notch, ее можно было легко использовать для связывания обнаружения нативного дельта-лиганда с совершенно новым набором ненативных генов-мишеней.
Barnea et al. Расширили эту модульную стратегию, вдохновленную Notch, путем создания новых транскрипционных выходов для других рецепторов, которые обычно не используют этот тип механизма активации протеаз [28]. Когда рецепторы, сопряженные с G-белком (GPCR), активируются своими специфическими лигандами, они часто рекрутируют β-аррестин, который участвует в подавлении передачи сигналов GPCR. Barnea et al. Слили аррестин с высокоспецифичной протеазой вируса травления табака (TEV), так что он был совместно задействован в активированных GPCR.Синтетический фактор транскрипции также был слит с цитоплазматическим хвостом GPCR, связанным сайтом расщепления TEV. Таким образом, когда сконструированный слитый белок GPCR активируется своим эндогенным лигандом, он рекрутирует партнера протеазы аррестин-TEV, который расщепляет и высвобождает домен фактора транскрипции из GPCR, посредством чего он может проникать в нуклеазу и активировать гены-мишени. Эта система успешно использовалась для связывания новых репортеров транскрипции с активацией широкого спектра специфических GPCR.Ответ очень специфичен благодаря специфичности расщепления TEV. В принципе, эту стратегию можно использовать для связывания любого эндогенного сигнала, опосредованного GPCR, с экспрессией желаемых генов-мишеней.
Barnea et al. Также использовали эту стратегию для связывания передачи сигналов эндогенной рецепторной тирозинкиназы (RTK) с новыми выходами транскрипции [28]. Большинство RTK при стимуляции активируют свои киназные домены, которые опосредуют аутофосфорилирование цитоплазматических тирозинов для рекрутирования белков, содержащих домен Sh3.Здесь протеаза TEV была слита с рекрутированными доменами Sh3, а синтетический фактор транскрипции был слит с цитоплазматическим хвостом RTK через сайт расщепления протеазой TEV. Итак, активация RTK ведет к рекрутированию слияния Sh3-домен-TEV, высвобождению ассоциированного с рецептором фактора транскрипции и транскрипции гена инженерии. Примечательно, что эта простая модульная стратегия может быть применена к нескольким классам рецепторов, если они привлекают определенный белок-партнер при активации.
Howard et al. Использовали модульность передачи сигналов RTK для перенаправления сигнала онкогенного роста на апоптотический ответ [29]. Они сконструировали новый адаптерный белок Sh3, в котором домен Sh3, распознающий активированный RTK, был слит с доменом эффектора смерти от Fadd. Таким образом, активация RTK привела к рекрутированию в мембрану домена смерти, что вызвало ответ клеточной смерти. Возможность увязки других новых результатов с этими ключевыми событиями найма еще недостаточно изучена.
Рецепторы, которые обнаруживают новые входные данные малых молекул
Вышеупомянутые стратегии сосредоточены на способах получения рецепторов, которые обнаруживают эндогенные сигнальные молекулы, и конструируют их так, чтобы вызывать новые ответы. Однако во многих случаях для клеточной инженерии могут потребоваться рецепторы, которые обнаруживают новые сигналы, для которых нет эндогенных рецепторов. Эти новые сигналы включают в себя небольшие молекулы, которые мы можем захотеть обеспечить внешнее управление инженерной системой.
Относительно хорошие успехи были достигнуты в использовании GPCR в качестве платформы для конструирования контролируемых рецепторов на малых молекулах.Некоторые GPCR, такие как опиоидные рецепторы, могут активироваться их эндогенными лигандами и специфическими низкомолекулярными агонистами. Конклин, Рот и его сотрудники сконструировали молекулы, известные как рецепторы, активируемые исключительно синтетическими лигандами (RASSL) [30,32]. Эти рецепторы мутированы так, что они не могут связывать свой эндогенный лиганд, но активируются и вызывают свой эндогенный нисходящий эффект в ответ на небольшой фармакологически инертный молекулярный агонист.
GPCR различаются по своим выходам, отчасти потому, что отдельные рецепторы связываются со специфическими гетеротримерными G-белками.Дальнейшая разработка дала версии RASSL, которые специфически связаны с каждым из этих отдельных нисходящих путей, тем самым позволяя малым молекулам контролировать очень разнообразный набор выходов. Эти RASSL были успешно применены у трансгенных мышей — по сути, перестраивая передачу сигналов в полноценном живом организме — в основном в качестве диагностического и аналитического инструмента. Применение было разнообразным, учитывая широкое использование GPCR в разных тканях. Например, мыши, несущие вкусовые нейроны, экспрессирующие RASSL, проявляли специфические сладкие (привлекательные) или горькие (аверсивные) ответы на воду, смешанную с агонистом (спирадолином), в зависимости от того, в каком типе нейрона они экспрессировались [33].Кроме того, экспрессия RASSL в клетках сердца позволяет контролировать частоту сердечных сокращений путем введения спирадолина [34]. То, что эти рецепторы in vivo так надежно работают, , намекает на их потенциальную полезность в более сложной клеточной инженерии.
Химические димеризаторы образуют другую стратегию достижения контроля малых молекул над передачей сигналов. Такие стратегии были рассмотрены в другом месте [35,36] и не будут здесь обсуждаться.
Рецепторы, которые обнаруживают определенные пользователем антигены
Было бы идеально разработать рецепторы, которые могут воспринимать ассоциированные с заболеванием антигены, такие как белок, сильно экспрессирующийся в опухоли или инфекционном агенте.Если бы рецепторы могли быть сконструированы для достижения такого же разнообразия и избирательности распознавания, что и антитела, можно было бы обнаруживать широкий спектр входных сигналов и связывать их с конкретными ответами. Химерные антигенные рецепторы (CAR) — рецепторы, созданные с использованием одноцепочечных антител (scFv) как часть механизма их обнаружения, — были разработаны как универсальный каркас этого типа. Эта стратегия проистекает из модульности рецепторов иммунных клеток, таких как рецептор Т-клеток. Хотя Т-клеточный рецептор представляет собой сложный мультибелковый комплекс, сшивания цитоплазматической области субъединицы дзета-цепи CD3 достаточно для индукции передачи сигналов Т-клетками [37].Дзета-цепь CD3 содержит мотивы, которые фосфорилируются при активации тирозинкиназами, такими как Lck, для индукции рекрутирования белков, содержащих домен Sh3, таких как киназа ZAP-70. Слияние цитоплазматической области дзета-цепи CD3 с внеклеточным одноцепочечным антителом (scFv) дает рецептор, часто называемый «Т-тельцем», который при экспрессии в Т-клетках приводит к целенаправленному уничтожению клеток, экспрессирующих узнаваемый антиген (предположительно, поверхностные антигены сшивают и активируют химерные рецепторы) [38,39].Слияние scFv с внутриклеточной областью рецептора Fc (гамма-цепь) может дать химерный антиген-чувствительный рецептор аналогичного типа. Эти исследования подчеркивают модульность этих рецепторов: соединение нового внеклеточного распознающего элемента с нижележащими внутриклеточными сигнальными элементами приводит к новому датчику ввода / вывода.
Эти CAR первого поколения относительно примитивны и дали неоднозначные результаты. Т-клетки, экспрессирующие CAR, направленные против опухолевых антигенов, обладают умеренной сигнальной способностью по сравнению с эндогенными ответами TCR, умеренно пролиферируют ex vivo и in vivo и имеют низкую выживаемость при многократном воздействии антигена [16,17]].Улучшения в этом поведении были сделаны путем включения дополнительных модульных доменов во внутриклеточные области CARs, включая домены от молекул корецепторов, которые являются частью нормальной активации TCR, таким образом, возможно, имитируя более полную активированную внутриклеточную сборку [40,41]. Клетки, содержащие CAR следующего поколения, более эффективно контролируют опухоли ксенотрансплантата у мышей, и в настоящее время переносятся на клинические испытания [16]. Более сложная инженерия CAR может привести к еще большему улучшению терапевтической функции.
Датчики, которые обнаруживают физические сигналы, такие как свет
Еще одна интересная область исследований — разработка генетически закодированных датчиков, которые могут обнаруживать свет и преобразовывать его в конкретный биологический ответ, область, называемая оптогенетикой. Встречающиеся в природе светочувствительные белки растений, водорослей и бактерий можно модифицировать для использования в высших организмах, включая млекопитающих. Эти инструменты чрезвычайно полезны в качестве пространственно-временных шкал для контроля и анализа сложного клеточного и организменного поведения, особенно когда они экспрессируются с помощью промоторов, специфичных для клеточного типа.В долгосрочной перспективе оптогенетические инструменты могут использоваться для удаленного контроля клеток, используемых в терапевтических целях, хотя существуют серьезные технические проблемы, такие как то, как свет может доставляться в организм, которые необходимо будет преодолеть. Наиболее часто используемые сегодня оптогенетические инструменты — это белки микробного канала родопсин и галородопсин, которые широко используются для контроля функции нейронов. Они рассмотрены в другом месте [42] и не будут здесь подробно обсуждаться.
Совсем недавно появились дополнительные оптогенетические инструменты, которые могут быть применены к более широкому спектру клеточных сигнальных систем.Airan et al. Сконструировали набор активируемых светом GPCRs, которые могут связываться как с нижележащими Gs, так и с гетеротримерными G-белками Gq [43]. Были созданы химеры светочувствительной зрительной системы GPCR, родопсин (бычий), которые содержат внутриклеточные петли от Gq- и Gs-сопряженных адренергических рецепторов. Эндогенная молекула сетчатки — это светочувствительный хромофор. Эти новые инструменты значительно расширяют «словарь» передачи сигналов, которым можно управлять с помощью света, учитывая важность путей передачи сигналов Gq и Gs в различных типах клеток.
Еще более обобщенная стратегия управления светом включает использование контролируемых светом белковых взаимодействий. Временное взаимодействие конкретных белков-партнеров является основой многих внутриклеточных сигнальных событий (см. Ниже), и рецепторы могут быть обойдены, так что свет напрямую контролирует такие внутриклеточные взаимодействия. Левская и др. Использовали систему взаимодействия фитохрома, полученную из растений — связывание этого фоторецептора с его партнерским доменом PIF может включаться и выключаться с помощью определенных длин волн света — для рекрутирования определенных белков на мембрану точным пространственно-временным образом [44].В случае факторов обмена гуаниновых нуклеотидов (GEF), которые контролируют GTPases семейства Rho, это может быть использовано для запуска активации GTPase и последующих изменений цитоскелета, приводящих к световодному выпячиванию клеток. Хотя этот метод является мощным и потенциально применимым ко многим сигнальным взаимодействиям, система Phy-PIF требует добавления проницаемого для клетки хромофора, который не является эндогенным для клеток млекопитающих. Wu et al. Использовали светочувствительный домен LOV (свет-кислород-напряжение) (обнаруженный в растениях, водорослях и бактериях) для конформационной закупорки Rac GTPase контролируемым светом способом [45].Этот связывающий флавин домен обеспечивает еще один потенциально общий конформационный элемент управления светом, который может быть связан для управления различными сигнальными белками.
Инженерные системы обработки сигналов
В конечном итоге клетки решают, какие программы ответа выполнять на основе внутриклеточных сигнальных сетей, которые принимают и обрабатывают сигналы от сенсорных молекул (см. Выше). Недавняя работа в области сотовой инженерии была сосредоточена на понимании того, как эти сети функционируют для принятия решений и как их можно изменить.
Модульная логика обработки сигналов
Внутриклеточные сигнальные белки имеют высокую модульность (см. Выше). Большинство модулей делятся на два класса (). Первый класс — это ферментные домены, такие как киназы и фосфатазы, которые катализируют посттрансляционные модификации или конформационные изменения, с помощью которых сохраняется информация. В большинстве случаев эти каталитические домены входят в пары: ферменты-писатели (например, киназы) производят модификацию, а ферменты-стиратели (например, фосфатазы) удаляют модификацию.Второй класс — это регуляторные домены или домены взаимодействия, которые модулируют активность каталитических доменов или нацеливают их на конкретных партнеров или сайты в клетке. Эти модули могут опосредовать специфические белок-белковые взаимодействия (либо конститутивные взаимодействия, либо те, которые зависят от посттрансляционных модификаций, таких как фосфорилирование) или белок-мембранные взаимодействия. Таким образом, именно регуляторные домены и домены взаимодействия определяют, когда и где активируются каталитические домены и каким партнерам они передают информацию [5].
Модульная логика компонентов внутриклеточной сигнализацииa | ферментных и регуляторных доменов . Модульные сигнальные белки эукариот обычно состоят из ферментативных доменов и доменов локализации. Ферментные домены, такие как киназы и фосфатазы, а также GEF и GAP, катализируют регуляторные модификации, такие как фосфорилирование и активация GTPase, соответственно (ферментные домены часто входят в пары «писатель» и «стиратель», которые имеют противоположные активности).Эти ферментные домены регулируются и нацелены на домены взаимодействия, включая домены межбелкового взаимодействия, домены мембранного взаимодействия или трансмембранные домены.
b | различных классов многодоменных архитектур . Ферментативные домены могут быть непосредственно нацелены на определенные субстраты, партнеров или субклеточные участки посредством доменов взаимодействия. В качестве альтернативы они могут быть косвенно нацелены через адаптеры или белки каркаса, которые содержат несколько доменов взаимодействия.Домены взаимодействия могут также аллостерически регулировать каталитические домены, участвуя во внутримолекулярных аутоингибиторных взаимодействиях. Такие переключающие белки могут быть активированы конкурирующими лигандами, которые снимают аутоингибирование.
Эти разные классы модулей обнаруживаются в различных комбинациях и расположениях в сигнальных белках (). Каталитические домены, слитые с нацеливающими доменами, могут быть задействованы в определенных комплексах или участках мембраны, где они будут модифицировать определенные мишени; часто эти каталитические домены имеют высокую внутреннюю константу Михаэлиса (Km’s и, следовательно, требуют нацеливания с помощью дополнительных доменов взаимодействия для эффективного катализа.Иногда эти нацеленные взаимодействия регулируются, если, например, взаимодействие зависит от посттрансляционной модификации, такой как нацеливание белков домена Sh3 на аутофосфорилированные сайты pTyr на активированных RTK. Белки с двумя доменами взаимодействия могут действовать как адаптеры, которые переводят одно взаимодействие во второе, что приводит к увеличению гибкости ответа в зависимости от адаптерных белков, которые экспрессируются в конкретном типе клеток. Белки с множественными доменами взаимодействия могут также функционировать как скаффолдные белки, которые организуют несколько белков на пути в комплекс.Эти взаимодействия могут быть конститутивными или предопределенными, или индуцированными такими факторами, как фосфорилирование или конформационные изменения, которые открывают сайты взаимодействия. Таким образом, каркасные белки могут в принципе определять проводные связи сигнальных белков, а также контролировать, когда и где происходит передача сигналов [24, 20].
Вторая важная роль взаимодействия и регуляторных доменов — это непосредственный контроль активности каталитических доменов. Во многих случаях домены взаимодействия участвуют во внутримолекулярных аутоингибиторных взаимодействиях, которые стерически закрывают каталитический домен или конформационно возмущают его — тип регуляции, называемый модульной аллостерией [46].Связывание конкурирующих межмолекулярных лигандов с доменами взаимодействия индуцирует каталитическую активность белков. Часто множественные домены взаимодействия участвуют в автоингибировании каталитического домена кооперативным или иерархическим образом [47, 48]. Эти белки могут функционировать как сложные переключатели с множеством входов, которые требуют определенной комбинации входов для правильной активации. Кроме того, поскольку внешние лиганды активируют эти белки, локализация (управляемая этими взаимодействиями) может быть напрямую связана с активацией.
Разработка новых белковых переключателей
Лим и его сотрудники исследовали, можно ли использовать модульную аллостерическую логику многих природных эукариотических сигнальных белков для создания новых сигнальных переключателей путем рекомбинации доменов (). В самом деле, каталитические домены актинового регуляторного белка N-WASP и GEF семейства Rho могут быть связаны с новыми аутоингибиторными доменами с образованием белков, активность которых регулируется новыми лигандами [49,50]. Внутримолекулярное связывание любого из этих каталитических доменов с доменом PDZ и пептидом лиганда PDZ может давать переключатель, который активируется конкурирующим пептидом PDZ.Точно так же можно добавить несколько доменов взаимодействия, чтобы получить комбинаторный переключатель, отображающий управление логическим элементом И. В зависимости от точной конфигурации доменов и внутримолекулярных взаимодействий типы регуляции могут быть разными в ответ на разные конкурирующие внешние лиганды — один лиганд может активировать белок, а другой репрессировать его. Эти типы разнообразных взаимоотношений между регуляторными доменами напоминают разнообразное поведение, наблюдаемое в природных сигнальных белках, подтверждая представление о том, что этот вид архитектуры переключения облегчает эволюцию разнообразных комбинаторных регуляторных переключателей [48].Dueber et al. Также показали, что синтетические аутоингибирующие переключатели, использующие поливалентные взаимодействия одного и того же типа, приводят к переключениям, поведение активации которых может быть настроено кооперативно от линейного до цифрового ответа [51].
Инженерные схемы обработки сигналовa | инженерных переключателей аллостерических белков . Dueber et al [49,51] показали, что аллостерическая регуляция сигнального белка N-WASP может быть перепрограммирована путем рекомбинации каталитического домена из N-WASP с различными комбинациями доменов взаимодействия.Новые модели поведения включали управление с множеством входов (логический элемент И) и активную активацию, подобную переключателю.
b | с использованием белков каркаса в качестве молекулярной печатной платы для преобразования выходных сигналов . Связь входа / выхода киназного пути MAP в дрожжах может быть перенаправлена через сконструированный химерный каркас, который собирает новую комбинацию киназ [58]. Новые сайты взаимодействия также могут быть добавлены к каркасам для привлечения дополнительных модулирующих факторов.Эти дополнительные факторы могут быть построены синтетическими петлями обратной связи, которые могут быть использованы для создания путей, которые отображают разнообразную динамику передачи сигналов [62].
Каркасные белки как молекулярные схемы
Цепи внутриклеточной передачи сигналов также можно напрямую контролировать, используя регуляторные взаимодействия для перепрограммирования соединений путей. Например, каталитический домен киназы семейства Src, Hck, который обычно регулируется доменами Sh3 и Sh4, может быть слит с доменом PDZ и направлен in vivo для специфического фосфорилирования субстратов с мотивом лиганда PDZ [52].
Белки каркаса также могут быть использованы для создания новых взаимосвязей между входом и выходом пути. У дрожжей существует множество функционально различных киназных путей митоген-активированного протеина (MAP), которые регулируют ответы на феромон спаривания и осмотический стресс [53,54]. Эти пути имеют общие компоненты киназ, но остаются специфическими, потому что каждый путь организован отдельным каркасным белком [55–57]. Химерный каркасный белок, который организует избранных членов путей спаривания и осмотического стресса, дает неприродный путь, в котором феромон спаривания специфически индуцирует программу реакции осмостресса в vivo [58].Подобные ковалентные слияния, которые, подобно каркасу, вызывают взаимодействие между двумя сигнальными белками, могут быть использованы для принудительной передачи сигнала по единственному пути [59].
Совсем недавно было показано, что каркасные белки не только опосредуют линейные отношения ввода / вывода путей, но также координируют набор модуляторных факторов, которые формируют дозовую зависимость и динамику ответа пути [60,61]. Вдохновленный этими природными примерами, Башор и др. Показали, что дрожжевой скаффолд MAP-киназы, белок Ste5, можно использовать в качестве молекулярной печатной платы, чтобы гибко изменять количественное поведение реакции спаривания [62].Слияние дополнительного сайта синтетического взаимодействия с каркасом Ste5 (с использованием пары гетеродимеров лейциновой застежки) способствует привлечению новых модулирующих факторов, таких как фосфатаза MAPK, которая подавляет ответ пути. Однако, если экспрессия и рекрутирование фосфатазы связаны с выходным сигналом пути, возникает петля отрицательной обратной связи, которая приводит к адаптации — временный ответ, за которым следует автоматический возврат к более низким уровням выхода, что является ключевым поведением во многих биологических сенсорных системах.Связывая по-разному положительные и отрицательные модуляторы пути, этот небольшой набор элементов управления каркасом может быть использован для генерации очень разнообразных дозовых реакций и динамического поведения, включая высоко кооперативное переключение, отложенные ответы, ускоренные ответы и генерацию импульсов. Эти исследования показывают, как организующие центры, такие как каркас, являются богатой платформой для обработки и формирования внутриклеточной передачи сигналов посредством эволюции или инженерии.
Инженерная пространственная самоорганизация
Один из наиболее плохо изученных аспектов передачи сигналов в клетке — это то, как контуры, состоящие из диффундирующих молекул, могут приводить к высокоточной пространственной организации в клетке, такой как направленная поляризация и миграция.Этот тип самоорганизации является аспектом схемы управления, где нет хороших электронных или инженерных аналогов, и где биология может обучать инженерии.
Инженерные принципы применяются для понимания механизма поляризации почкующихся дрожжей, S. cerevisae . Поляризация контролируется GTPase Cdc42, которая в конечном итоге локализуется в одном сайте материнской клетки, приводя к образованию единственной почки, которая врастает в дочернюю клетку [63].Примечательно, что этот процесс приводит к образованию единственной бутоны почти со 100% надежностью. Цепь положительной обратной связи с участием Cdc42 GTPase является ключевой в поляризации: активный Cdc42 на мембране рекрутирует цитоплазматический белок GEF Bem1, который активирует и локализует дополнительный Cdc42 [64]. Хотя этот вид петли обратной связи ведет к образованию фокусов Cdc42, быстрая диффузия и перераспределение Bem1 между конкурирующими фокусами может быть важным, чтобы позволить одному из фокусов стать доминирующим, что ведет к сингулярности почкования.Эффект замедления диффузии и перераспределения Bem1 за счет связывания его с трансмембранным мотивом был проанализирован [65]. Bem1, привязанный к мембране, может спасти летальность от нокаута Bem1, но не может подвергаться диффузии в цитоплазме. Вместо этого он доставлялся к плазматической мембране в везикулах через актиновые кабели (также координируемые фокусами Cdc42) и от мембранных фокусов посредством эндоцитоза и, таким образом, перераспределялся намного медленнее. Наблюдались серьезные дефекты сингулярности, такие как множество устойчивых конкурирующих фокусов Cdc42, и частота многопочкованных клеток увеличивалась до ~ 5%.Подобные исследования помогают выявить требования к точно контролируемой пространственной самоорганизации и предполагают, что мы можем научиться создавать сигнальные цепи, которые производят индивидуальные пространственные результаты с важным терапевтическим поведением (например, регенеративная медицина, которая требует определенной клеточной морфологии и ориентации).
Создание предсказуемой инженерии передачи сигналов
Исследования, приведенные выше, показывают, что сигнальные системы являются высокомодульными и пластичными и рекомбинирующие модули, особенно каталитические домены с новыми регуляторными доменами, могут приводить к отличному ответному поведению.Таким образом, вопрос уже не в том, можно ли спроектировать сигнальные системы для получения нового поведения, а в том, можно ли их спроектировать таким образом, чтобы мы могли предсказать, какое поведение проявится и насколько успешной будет каждая спроектированная схема.
Проблема непредвиденных перекрестных помех
Одна из основных проблем, связанных с передачей сигналов инженерной клетки, заключается в том, что естественные компоненты — инструментарий доступных доменов — повторно используются, что может привести к непредвиденным перекрестным помехам. Приведут ли инженерные взаимодействия, которые вы создаете, к специфическому фосфорилированию желаемого белка, или используемый домен также будет перекрестно взаимодействовать с другими мишенями, конкурентно титруя важные физиологические взаимодействия и приводя к непредвиденным эффектам или сбоям в спроектированной схеме? Часто природные части не обладают абсолютной специфичностью, и эволюция, скорее всего, использует сложные сети перекрестной реактивности, чтобы обеспечить важную скоординированную регуляцию.Хотя такая сложная система, похожая на нейронную сеть, может обеспечить преимущества для клетки, это проклятие для прогнозной инженерии.
Представляя будущий инструментарий сигнализации
Одним из решений этой проблемы является сборка инструментария из деталей, специально оптимизированных для проектирования. Этот вопрос важен для любого типа сигнальной части, но мы сосредоточимся на том, как собрать полезный инструментарий из частей, взаимодействующих с белками ().
Улучшение инструментария для предсказуемой инженерии клеточной сигнализации: части ортогонального взаимодействияНативная клетка имеет свой собственный репетитор модулей взаимодействия с белками, и поэтому сложно разработать новые функции с использованием связанных модулей взаимодействия, которые могут показывать непреднамеренные и непреднамеренные перекрестные помехи в камере.Оптимизированный набор взаимодействующих частей может значительно повысить предсказуемость клеточной инженерии, исключив возможность непреднамеренных перекрестных помех. Несколько стратегий оптимизации включают разработку модулей взаимодействия, которые используют неиспользованную специфичность; разработка составных, многодоменных взаимодействий; объединение модулей взаимодействия с новым субклеточным нацеливанием; и импорт модулей ортогонального взаимодействия (либо созданных синтетически, либо из других организмов), которых нет в клетке-хозяине.
Хотя природа неоднократно использовала семейства частей, такие как домены взаимодействия определенного типа, недавние исследования показывают, что в некоторых случаях члены семейства содержат неиспользуемые сайты узнавания внутри этих доменов. Их можно использовать для создания пар домен-пептид, которые одновременно оптимизированы для взаимодействия со своим правильным партнером, избегая при этом перекрестного взаимодействия с другими членами семейства [66,67]. Фактически были сконструированы пары PDZ-домен-лиганд и гетеродимеризующиеся пары лейциновой застежки-молнии, которые оптимизированы, чтобы избежать перекрестной реакции с естественными доменами того же типа [68,69].Избирательность и предсказуемость существующих доменов взаимодействия также можно улучшить путем разработки составных взаимодействий. Конечно, многодоменное сотрудничество — естественный механизм повышения специфичности. Но новый поворот в этом вопросе — это разработка составных двухкомпонентных взаимодействий типа «раскладушка». Koide et al. Взяли домен PDZ и слили его с доменом фибронектина [70]. Используя фаговый дисплей, они отобрали варианты этого тандемного домена, которые связывают определенный пептид, так что он находится между двумя доменами.Резко увеличенная площадь распознавания приводит к взаимодействиям с гораздо более высокой специфичностью и сродством. Другое решение для специфичности, которое наблюдается в природе, — это дифференциальная компартментализация. Если нацеливающие мотивы могут быть использованы для локализации партнерских белков в определенных органеллах или клеточных участках, то мотивы взаимодействия, вероятно, будут функционировать более специфическим образом, особенно если в этом месте или органелле происходит мало или совсем не происходит конкурирующих взаимодействий этого типа.
Альтернативный подход к достижению надежной специфичности заключается в импорте доменов из других организмов, которых нет в создаваемом хозяине. Напр., PDZ домены могут быть импортированы в дрожжи (у которых отсутствует большинство таких доменов), хотя возможность случайных перекрестных реагирующих партнеров не может быть исключена [58]. Примером ортогональной молекулярной системы, которая была успешно перенесена на нового хозяина, является бактериальная рекомбиназная система Cre-Lox, которая надежно используется для создания сложных хромосомных перестроек в сложных организмах, включая мышей [71].
Таким образом, представляя инструментарий будущего, можно захотеть создать набор из десяти или около того пар взаимодействия белков, оптимизированных для конкретного выбранного организма (например, E.coli , S.cerevisae , млекопитающие) в том, что они ортогональны, то есть известно, что они не реагируют перекрестно с протеомом хозяина или белками в наборе инструментов, за исключением их родственного лиганда. Также важно, чтобы эти взаимодействия были настраиваемыми, поэтому серия лигандов для каждого домена взаимодействия, которые различаются по аффинности на несколько порядков, были бы идеальными.Это позволило бы систематически исследовать, как сродство вербовки меняет поведение системы.
Комбинаторный дизайн и прогнозирование
Другой другой, но все же дополнительный подход к предсказуемому проектированию передачи сигналов соты состоит в использовании комбинаторной изменчивости. В ходе естественной эволюции рекомбинация сигнальных модулей для генерации новой функции, по-видимому, не была спроектирована или направлена, а скорее была относительно случайной, и именно естественный отбор выявил события перепрограммирования, которые привели к преимуществам приспособленности.Таким образом, очень плодотворным подходом, учитывая отсутствие предсказуемости в клеточной инженерии, могло бы быть построение комбинаторных библиотек синтетических схем и выбор желаемой функции [25,72]. Более того, этот подход можно было бы комбинировать с полу- прогнозное проектирование, при котором могут быть разработаны общие архитектуры спроектированных схем, но комбинаторные методы используются для поиска в более широком диапазоне пространства параметров (с использованием вариантов каждого модуля в библиотеке). Сосредоточение внимания на комбинаторном выборе может также обеспечить очень полезную стратегию на заре синтетической биологии, поскольку это может помочь нам быстрее узнать о основных принципах проектирования.
Outlook
Цель понимания того, как клетки общаются и принимают решения, остается очень привлекательной, особенно потому, что понимание молекулярного языка внутри клетки может позволить нам общаться с клетками и инструктировать их выполнять новые запрограммированные функции. Наша способность перестраивать клеточную сигнализацию может обеспечить множество мощных приложений, таких как терапевтические клетки, запрограммированные на обнаружение селективного набора сигналов, связанных с заболеванием, и на локальный ответ точно настроенным образом.
Хотя эволюция достигла такого рода инноваций и точной инженерии клеточных функций, мы только начинаем понимать, как достичь такого рода цели. У нас есть хорошее фундаментальное понимание логики клеточных сигнальных механизмов и источников функциональной пластичности. Кроме того, были сделаны первые важные шаги в разработке новых рецепторно-сенсорных систем, а также новых или модифицированных схем обработки внутриклеточных сигналов. Несмотря на эти инструменты, на сегодняшний день было приложено очень мало усилий для того, чтобы связать эти типы компонентов новыми способами, чтобы получить более крупные интегральные схемы, способные давать очень точные и точные отклики.Такие усилия продолжаются. Например, Cell Propulsion Lab — это наномедицинский центр Национального института здравоохранения (http://nihroadmap.nih.gov/nanomedicine/devcenters/cellularcontrol.asp), который пытается использовать относительно простые противоопухолевые иммунные клетки, созданные с использованием синтетических рецепторов химерных антигенов ( CAR), и улучшают обработку их сигналов и набор ответов, которые они вызывают, чтобы оптимизировать клетки для экспансии ex vivo, , in vivo, выживания, противоопухолевой цитотоксичности и нарушения благоприятного микроокружения опухоли.Будет интересно увидеть, как будут развиваться эти типы усилий и как эти проблемы повысят сложность и надежность сотовой инженерии.
Новейшие инженерные датчики сигнализацииa | перенаправление собственных входов на новые выходы . С-концевой домен рецептора notch представляет собой фактор транскрипции, который высвобождается в результате трансмембранного протеолиза при активации лигандом дельта. Замена альтернативным доменом фактора транскрипции дает новый ответ экспрессии гена [26].Выход рецептора, сопряженного с G-белком (GPCR), может быть перенаправлен аналогичным образом путем слияния домена фактора транскрипции через привязку с сайтом протеазы TEV. Активация GPCR приводит к привлечению белка аррестина. Если в клетке экспрессируется слияние протеазы аррестин-TEV, активация GPCR приводит к высвобождению фактора транскрипции и новому выходу экспрессии гена [28]. Таким образом, активация GPCR может быть произвольно связана с новым транскрипционным выходом. Выход рецепторной тирозинкиназы (RTK) может быть перенаправлен за счет привлечения синтетических адаптеров домена Sh3 или PTB к активированному и фосфорилированному тирозин рецептору.Домен Sh3 может быть использован для рекрутирования протеазы TEV (чтобы снова высвободить искусственно связанный транскрипционный домен) [28] или для рекрутирования новых эффекторных доменов, таких как те, которые участвуют в гибели клеток [29].
b | инженерный новаторский контроль ввода для собственных ответов . GPCR были сконструированы так, чтобы их контролировали низкомолекулярные агонисты путем мутации их внеклеточной поверхности, так что они больше не связывают свои эндогенные лиганды (рецепторы, активируемые исключительно синтетическим лигандом — RASSL [32]).Рецепторы, которые активируют Т-клетки в ответ на произвольные входные данные, могут быть созданы путем слияния сконструированных одноцепочечных антител (scFv) с внутриклеточной областью Т-клеточного рецептора (дзета-цепь CD3), которые называются рецепторами химерных антигенов (CARs [16, 17]). Событие передачи сигнала, опосредованное рекрутингом, может быть помещено под световой контроль путем замены эндогенного взаимодействия на светозащитное взаимодействие, пара взаимодействий Phytochrome-PIF от растений [44].
Инженерно-пространственное регулированиеa | Цепь поляризации дикого типа контролирует образование одиночных почек. В почкующихся дрожжах локализованная активация полярности GTPase Cdc42 усиливается петлей положительной обратной связи — активный Cdc42 рекрутирует каркасный белок Bem1, совместно собирает активированную p21 киназу (PAK — Ste20) и Cdc42 GEF (Cdc24). Хотя клетка может иметь несколько фокусов Cdc42, они быстро распадаются на один доминантный фокус, который развивается только в клетки. Предполагается, что быстрая скорость обмена диффундирующим комплексом Bem1 / PAK / GEF между конкурирующими фокусами Cdc42 является критической для разделения в один доминантный фокус.
b | синтетическая цепь медленной поляризации приводит к образованию множественных бутонов . Чтобы проверить эту гипотезу, Bem1 был искусственно привязан к мембране через слитый мотив нацеливания на мембрану [65]. Хотя этот связанный с мембраной Bem1 может должным образом собирать комплекс Bem1 / PAK / GEF на участках активности Cdc42 (т.е. петле положительной обратной связи), обмен комплексом между конкурирующими фокусами Cdc42 происходит медленно (зависит от везикулярного транспорта через актиновые кабели и эндоцитоза) .Эта синтетическая поляризационная схема, следовательно, приводит к плохому разрешению конкурирующих фокусов Cdc42 и гораздо более высокой частоте (5% против ~ 0%) многопучковых клеток (микрофотографии из [65]).
Ссылки
2. Киль Ч., Юс Э., Серрано Л. Инженерные пути передачи сигналов. Клетка. 2010. 140 (1): 33–47. [PubMed] [Google Scholar] 3. Sprinzak D, Elowitz MB. Реконструкция генетических цепей. Природа. 2005; 438: 443–8. [PubMed] [Google Scholar] 4. Мукхерджи С., ван Ауденаарден А. Синтетическая биология: понимание биологического дизайна из синтетических цепей.Nat Rev Genet. 2009; 10: 859–71. [Бесплатная статья PMC] [PubMed] [Google Scholar] 5. Башор CJ, Хорвиц AA, Peisajovich SG, Lim WA. Перепрограммирование клеток: синтетическая биология как инструмент для исследования организационных принципов живых систем. Анну Рев Биофиз. 2010 16 февраля; [Epub перед печатью] [Бесплатная статья PMC] [PubMed] [Google Scholar] 6. Yeh BJ, Lim WA. Синтетическая биология: уроки истории синтетической органической химии. Nat Chem Biol. 2007; 3: 521–5. [PubMed] [Google Scholar] 7. Вайнберг Р. Биология рака.Наука о гирляндах; 2006. [Google Scholar] 9. Мюнтер С., Вэй М., Фришкнехт Ф. Сигнализация во время инфекции патогена. Sci STKE. 2006; 2006: re5. [PubMed] [Google Scholar] 10. Shan L, He P, Sheen J. Перехват сигнальных каскадов MAPK хозяина с помощью бактериальных эффекторов III типа. Клеточный микроб-хозяин. 2007; 1: 167–74. [PubMed] [Google Scholar] 11. Кискинис Э., Эгган К. Прогресс в клиническом применении плюрипотентных стволовых клеток для конкретных пациентов. J Clin Invest. 2010; 120: 51–9. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12.Линдвалл О., Кокая З. Стволовые клетки при нейродегенеративных расстройствах человека — время для клинического перевода? J Clin Invest. 2010; 120: 29–40. [Бесплатная статья PMC] [PubMed] [Google Scholar] 14. Варела-Рохена А., Карпенито С., Перес Э., Ричардсон М., Парри Р., Милон М., Шоллер Дж., Хао Х, Мексас А., Кэрролл Р. Г., Чемпион июня, Райли Дж. Л.. Генная инженерия Т-клеток для адоптивной иммунотерапии. Immunol Res. 2008; 42: 166–81. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Ли С.К., Чжоу Х., Хэм Т.С., Ли Т.С., Кизлинг Д.Д. Метаболическая инженерия микроорганизмов для производства биотоплива: от насекомых до синтетической биологии и топлива.Curr Opin Biotechnol. 2008; 19: 556–63. [PubMed] [Google Scholar] 16. Sadelain M, Brentjens R, Rivière I. Перспективы и потенциальные ловушки химерных антигенных рецепторов. Curr Opin Immunol. 2009; 21: 215–23. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Tlsty TD, Coussens LM. Строма опухоли и регуляция развития рака. Анну Рев Патол. 2006; 1: 119–50. [PubMed] [Google Scholar] 19. Поусон Т., Нэш П. Сборка клеточных регуляторных систем через домены взаимодействия белков. Наука. 2003; 300: 445–52.[PubMed] [Google Scholar] 20. Бхаттачарья Р.П., Ременьи А., Йе Б.Дж., Лим В.А. Домены, мотивы и каркасы: роль модульных взаимодействий в эволюции и подключении сигнальных цепей клетки. Анну Рев Биохим. 2006; 75: 655–80. [PubMed] [Google Scholar] 23. Кэрролл С.Б. Эво-дево и расширяющийся эволюционный синтез: генетическая теория морфологической эволюции. Клетка. 2008. 134: 25–36. [PubMed] [Google Scholar] 24. Скотт Дж. Д., Поусон Т. Передача сигналов в клетках в пространстве и времени: где белки объединяются, а когда разделяются.Наука. 2009; 326: 1220–4. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Пейсайович С., Гарбарино Дж., Вей П., Лим В.А. Быстрая диверсификация сигнальных фенотипов клеток за счет рекомбинации модульных доменов. Наука. в прессе. [Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Struhl G, Adachi A. Ядерный доступ и действие notch in vivo. Клетка. 1998. 93: 649–60. [PubMed] [Google Scholar] 27. Спринзак Д., Лакханпал А., ЛеБон Л., Сантат Л.А., Фонтес М.Э., Андерсон Г.А., Гарсия-Охалво Дж., Эловиц МБ. Цис-взаимодействия между Notch и Delta создают взаимоисключающие сигнальные состояния.Природа. в прессе. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Barnea G, Strapps W, Herrada G, Berman Y, Ong J, Kloss B, Axel R, Lee KJ. Генетический дизайн сигнальных каскадов для регистрации активации рецепторов. Proc Natl Acad Sci USA. 2008; 105: 64–9. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Howard PL, Chia MC, Del Rizzo S, Liu FF, Pawson T. Перенаправление передачи сигналов тирозинкиназы на путь апоптоза каспазы через химерные адаптерные белки. Proc Natl Acad Sci U S. A. 2003; 100: 11267–72.[Бесплатная статья PMC] [PubMed] [Google Scholar] 30. Conklin BR, Hsiao EC, Claeysen S, Dumuis A, Srinivasan S, Forsayeth JR, Guettier JM, Chang WC, Pei Y, McCarthy KD, Nissenson RA, Wess J, Bockaert J, Roth BL. Разработка сигнальных путей GPCR с помощью RASSL. Нат методы. 2008; 5: 673–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31. Армбрустер Б.Н., Ли Х, Пауш М.Х., Херлитце С., Рот Б.Л. Доработка замка для соответствия ключу для создания семейства рецепторов, связанных с G-белком, активно активируемых инертным лигандом.Proc Natl Acad Sci U S. A. 2007; 104: 5163–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 32. Трус П., Вада Х.Г., Фальк М.С., Чан С.Д., Мэн Ф., Акил Х., Конклин Б.Р. Управление передачей сигналов с помощью специально разработанного Gi-связанного рецептора. Proc Natl Acad Sci U S. A. 1998; 95: 352–7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 33. Zhao GQ, Zhang Y, Hoon MA, Chandrashekar J, Erlenbach I., Ryba NJ, Zuker CS. Рецепторы сладкого вкуса и вкуса умами млекопитающих. Клетка. 2003. 115: 255–66. [PubMed] [Google Scholar] 34. Redfern CH, Coward P, Дегтярев М.Ю., Lee EK, Kwa AT, Hennighausen L, Bujard H, Fishman GI, Conklin BR.Условная экспрессия и передача сигналов специально сконструированного Gi-сопряженного рецептора у трансгенных мышей. Nat Biotechnol. 1999; 17: 165–9. [PubMed] [Google Scholar] 35. Корсон Т.В., Аберли Н., Экипаж СМ. Дизайн и применение бифункциональных малых молекул: почему две головы лучше, чем одна. ACS Chem Biol. 2008; 3: 677–692. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Поллок Р., Клэксон Т. Экспрессия гена, регулируемая димеризером. Curr Opin Biotechnol. 2002; 13: 459–67. [PubMed] [Google Scholar] 37. Ирвинг Б.А., Вайс А.Цитоплазматического домена дзета-цепи Т-клеточного рецептора достаточно для соединения с рецептор-ассоциированными путями передачи сигнала. Клетка. 1991; 64: 891–901. [PubMed] [Google Scholar] 38. Гросс Г., Горохов Г., Вакс Т., Эшхар З. Создание эффекторных Т-клеток, экспрессирующих химерный Т-клеточный рецептор со специфичностью типа антитела. Transplant Proc. 1989; 21: 127–30. [PubMed] [Google Scholar] 39. Eshhar Z, Waks T, Bendavid A, Schindler DG. Функциональная экспрессия генов химерных рецепторов в Т-клетках человека. J Immunol Methods.2001; 248: 67–76. [PubMed] [Google Scholar] 40. Maher J, Brentjens RJ, Gunset G, Rivière I, Sadelain M. Цитотоксичность и пролиферация Т-лимфоцитов человека, управляемые одним химерным рецептором TCRzeta / CD28. Nat Biotechnol. 2002; 20: 70–5. [PubMed] [Google Scholar] 41. Карпенито К., Милоне М.К., Хассан Р., Симонет Дж. К., Лакхал М., Сухоски М. М., Варела-Рохена А., Хейнс К. М., Хейтджан Д. Ф., Альбельда С. М., Кэрролл Р. Г., Райли Дж. Л., Пастан I, Джун Чемпион. Контроль крупных установленных ксенотрансплантатов опухолей с генетически перенаправленными человеческими Т-клетками, содержащими домены CD28 и CD137.Proc Natl Acad Sci U S. A. 2009; 106: 3360–5. [Бесплатная статья PMC] [PubMed] [Google Scholar] 42. Чжан Ф., Араванис А.М., Адамантидис А., де Лесеа Л., Дейссерот К. Автоматические выключатели: оптические технологии для исследования нейронных сигналов и систем. Nat Rev Neurosci. 2007; 8: 577–81. [PubMed] [Google Scholar] 43. Airan RD, Thompson KR, Fenno LE, Bernstein H, Deisseroth K. Временный контроль внутриклеточной передачи сигналов in vivo. Природа. 2009; 458: 1025–9. [PubMed] [Google Scholar] 44. Левская А, Вайнер О.Д., Лим В.А., Фойгт CA.Пространственно-временной контроль клеточной передачи сигналов с использованием переключаемого светом белкового взаимодействия. Природа. 2009; 461: 997–1001. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Wu YI, Frey D, Lungu OI, Jaehrig A, Schlichting I., Kuhlman B, Hahn KM. Генетически кодируемый фотоактивируемый Rac контролирует подвижность живых клеток. Природа. 2009; 461: 104–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 46. Lim WA. Модульная логика сигнальных белков: построение аллостерических переключателей из простых связывающих доменов. Curr Opin Struct Biol.2002; 12: 61–8. [PubMed] [Google Scholar] 47. Prehoda KE, Scott JA, Mullins RD, Lim WA. Интеграция нескольких сигналов посредством совместной регуляции комплекса N-WASP-Arp2 / 3. Наука. 2000; 290: 801–6. [PubMed] [Google Scholar] 48. Ю Б., Мартинс И.Р., Ли П., Амарасинге Г.К., Уметани Дж., Фернандес-Запико М.Э., Билладо Д.Д., Мачиус М., Томчик Д.Р., Розен М.К. Структурные и энергетические механизмы кооперативного аутоингибирования и активации Vav1. Клетка. 2010. 140: 246–56. [Бесплатная статья PMC] [PubMed] [Google Scholar] 49.Dueber JE, Yeh BJ, Chak K, Lim WA. Перепрограммирование управления переключателем аллостерической сигнализации посредством модульной рекомбинации. Наука. 2003; 301: 1904–8. [PubMed] [Google Scholar] 50. Йе Би Джей, Рутильяно Р. Дж., Деб А., Бар-Саги Д., Лим ВА. Перестройка путей клеточной морфологии с помощью факторов обмена синтетических гуаниновых нуклеотидов. Природа. 2007. 447: 596–600. [PubMed] [Google Scholar] 51. Дуэбер Дж. Э., Мирский Е. А., Лим В. А.. Разработка синтетических сигнальных белков со сверхчувствительным управлением вводом / выводом. Nat Biotechnol.2007; 25: 660–2. [PubMed] [Google Scholar] 52. Ядав С.С., Йе Б.Дж., Крэддок Б.П., Лим В.А., Миллер В.Т. Реинжиниринг сигнальных свойств киназы семейства Src. Биохимия. 2009. 48: 10956–62. [Бесплатная статья PMC] [PubMed] [Google Scholar] 53. Гаррингтон Т.П., Джонсон Г.Л. Организация и регуляция сигнальных путей митоген-активируемой протеинкиназы. Curr Opin Cell Biol. 1999; 11: 211–8. [PubMed] [Google Scholar] 54. Шварц М.А., Мадхани HD. Принципы специфичности передачи сигналов MAP-киназы у Saccharomyces cerevisiae.Анну Рев Жене. 2004. 38: 725–48. [PubMed] [Google Scholar] 55. Чой К.Ю., Саттерберг Б., Лион DM, Элион Э.А. Ste5 связывает несколько протеинкиназ в каскаде MAP-киназ, необходимых для спаривания у S. cerevisiae. Клетка. 1994. 78 (3): 499–512. [PubMed] [Google Scholar] 56. Printen JA, Sprague GF., Jr. Белковые взаимодействия в пути ответа феромонов дрожжей: Ste5p взаимодействует со всеми членами каскада киназ MAP. Генетика. 1994. 138 (3): 609–19. [Бесплатная статья PMC] [PubMed] [Google Scholar] 57. Посас Ф, Сайто Х.Осмотическая активация пути HOG MAPK через Ste11p MAPKKK: роль каркаса Pbs2p MAPKK. Наука. 1997. 276 (5319): 1702–5. [PubMed] [Google Scholar] 58. Park SH, Zarrinpar A, Lim WA. Перестройка путей MAP-киназы с использованием альтернативных механизмов сборки каркаса. Наука. 2003; 299: 1061–4. [PubMed] [Google Scholar] 59. Харрис К., Ламсон Р.Е., Нельсон Б., Хьюз Т.Р., Мартон М.Дж., Робертс С.Дж., Бун С., Прайчак П.М. Роль каркасов в специфичности пути киназы MAP, выявленная путем индивидуального дизайна сигнальных белков, предназначенных для этого пути.Curr Biol. 2001. 11 (23): 1815–24. [PubMed] [Google Scholar] 60. Dodge-Kafka KL, Soughayer J, Pare GC, Carlisle Michel JJ, Langeberg LK, Kapiloff MS, Scott JD. Заякоренный белок mAKAP протеинкиназы А координирует два интегрированных эффекторных пути цАМФ. Природа. 2005. 437 (7058): 574–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 61. Мишра П., Соколич М., Уолл М.А., Грейвс Дж., Ван З., Ранганатан Р. Динамическое формирование каркаса в системе передачи сигналов, связанной с G-белком. Клетка. 2007. 131 (1): 80–92. [PubMed] [Google Scholar] 62.Башор CJ, Helman NC, Yan S, Lim WA. Использование инженерных взаимодействий каркаса для изменения динамики передачи сигналов пути киназы MAP. Наука. 2008. 319 (5869): 1539–43. [PubMed] [Google Scholar] 63. Чант Дж. Полярность клеток в дрожжах. Annu Rev Cell Dev Biol. 1999; 15: 365–91. [PubMed] [Google Scholar] 64. Козубовски Л., Сайто К., Джонсон Дж. М., Хауэлл А. С., Зила Т. Р., Лью Д. Д.. Поляризация, нарушающая симметрию, управляемая комплексом Cdc42p GEF-PAK. Curr Biol. 2008. 18 (22): 1719–26. [Бесплатная статья PMC] [PubMed] [Google Scholar] 65. Howell AS, Savage NS, Johnson SA, Bose I, Wagner AW, Zyla TR, Nijhout HF, Reed MC, Goryachev AB, Lew DJ.Необычность в поляризации: перестройка дрожжевых клеток для образования двух бутонов. Клетка. 2009. 139 (4): 731–43. [Бесплатная статья PMC] [PubMed] [Google Scholar] 66. Зарринпар А, Парк SH, Лим WA. Оптимизация специфичности в сети взаимодействия белков клетки путем отрицательного отбора. Природа. 2003. 426 (6967): 676–80. [PubMed] [Google Scholar] 67. Stiffler MA, Chen JR, Grantcharova VP, Lei Y, Fuchs D, Allen JE, Zaslavskaia LA, MacBeath G. Селективность связывания домена PDZ оптимизирована по протеому мыши. Наука. 2007. 317 (5836): 364–9.[Бесплатная статья PMC] [PubMed] [Google Scholar] 68. Эрнст А., Сазинский С.Л., Хуэй С., Каррелл Б., Дхарси М., Сешагири С., Бадер Г.Д., Сидху С.С. Быстрая эволюция функциональной сложности в семействе доменов. Sci Signal. 2009; 2 (87): ра50. [PubMed] [Google Scholar] 69. Григорян Г., Рейнке А.В., Китинг А.Е. Дизайн специфичности взаимодействия с белками дает селективные bZIP-связывающие пептиды. Природа. 2009. 458 (7240): 859–64. [Бесплатная статья PMC] [PubMed] [Google Scholar] 70. Хуанг Дж., Коиде А., Макабе К., Коиде С. Дизайн скачков функции белка путем направленной эволюции интерфейса домена.Proc Natl Acad Sci U S. A. 2008; 105 (18): 6578–83. [Бесплатная статья PMC] [PubMed] [Google Scholar] 71. Зауэр Б. Индуцируемое нацеливание гена у мышей с использованием системы Cre / lox. Методы. 1998. 14 (4): 381–92. [PubMed] [Google Scholar]Разработка индивидуальных сигнальных цепей клеток
Nat Rev Mol Cell Biol. Авторская рукопись; доступно в PMC 2010 8 ноября.
Опубликован в окончательной отредактированной форме как:
PMCID: PMC2975372
NIHMSID: NIHMS246517
Wendell A.Lim
HHMI и отдел клеточной и молекулярной фармакологии, UCSF, The Cell Propulsion Lab, NIH Nanomedicine Development Center, NSF Synthetic Biology Engineering Research Center
Венделл А. Лим, HHMI и отдел клеточной и молекулярной фармакологии, UCSF , Лаборатория движения клеток, Центр разработки наномедицины NIH, Исследовательский центр синтетической биологии NSF;
См. Другие статьи в PMC, в которых цитируется опубликованная статья.Abstract
Живые клетки развили широкий спектр сложных сигнальных реакций, которые позволяют им выживать в различных условиях окружающей среды и выполнять определенные физиологические функции.Наше все более сложное понимание молекулярных механизмов клеточных сигнальных сетей у эукариот выявило удивительно модульную организацию, и синтетические биологи изучают, как это можно использовать для создания клеток с новым сигнальным поведением. Этот подход начинает раскрывать логику того, как клетки могут развивать инновационные новые функции, и подталкивает нас к захватывающей возможности создания пользовательских клеток с точными функциями восприятия и реакции, которые могут быть полезны в медицине и биотехнологии.
Ключевые слова: передача сигналов клеток, инженерия, синтетическая биология, терапевтический, MAP-киназа, каркас, модули, белковые взаимодействия, N-WASP, рецепторы, GPCR, Notch, RTK, рак, адоптивная иммунотерапия, химерные антигенные рецепторы, Т-клетки. , оптический контроль, биопродукция
Живые клетки — это высокодинамичные системы, которые используют сложные молекулярные сигнальные цепи для мониторинга внешнего и внутреннего состояния и выполнения соответствующих физиологических реакций. Как и любая сенсорная машина, созданная или созданная человеком, эти клеточные сигнальные цепи содержат подсистемы принятия решений, которые действуют как сенсоры и процессоры (например, рецепторы и их последующие эффекторы), которые в конечном итоге контролируют различные подсистемы ответа (такие как транскрипция генов и динамика цитоскелета) ( ).Основная цель современной клеточной биологии — понять, как эти молекулярные сигнальные системы достигают своих сложных ответов, которые оптимально настроены для их физиологической роли. Хотя подавляющее большинство исследований нацелено на анализ, картирование и анализ сигнальных сетей клеток, наше растущее понимание того, как работают эти системы, привело к появлению радикально нового подхода — усилий по разработке и созданию собственных синтетических сигнальных цепей [1,2 ].
Общая организация и поведение сигнальных цепей ячеекa | Клетки обычно воспринимают стимулы окружающей среды через рецепторы и другие датчики .Затем эта информация обрабатывается внутриклеточными сигнальными сетями, которые, в свою очередь, задействуют различные клеточные продукты, включая экспрессию генов, секрецию, изменения цитоскелета и рост клеток.
b | Некоторые из основных проблем в развитии или разработке новых сигнальных цепей: : достижение правильной связи определенных входов и конкретных выходов; настройка количественного поведения сигнального ответа — доза-реакция и динамика — так, чтобы они были оптимальными для физиологической функции; и создание устойчивых пространственно самоорганизующихся процессов, таких как процессы, связанные с поляризацией клеток, направленной подвижностью, делением клеток и компартментализацией клеток.
Здесь мы сосредоточимся на синтетической биологии передачи сигналов и посмотрим, как можно спроектировать сигнальные схемы эукариотических клеток для создания клеток с заданным поведением передачи сигналов. Эукариотические клетки используют сети сигнальных белков, чтобы ощущать окружающую их среду и обеспечивать быстрые ответы. Поскольку сети обработки сигналов в клетках функционируют в трехмерном пространстве, они также контролируют сложные пространственные или морфологические клеточные реакции. Мы рассмотрим, как могут быть созданы сигнальные цепи с точным поведением реакции, учитывая, как определяется специфичность ответа (то есть, какие наборы выходных сигналов связаны с конкретным входом), как точно настроенная доза-реакция или временная динамика профили ответов оптимизированы для конкретных физиологических функций и того, как можно достичь сложного пространственного и морфологического контроля ().Мы также рассмотрим, почему появились усилия по разработке и созданию специализированных синтетических сигнальных цепей, как они могут обеспечить более глубокое видение принципов и механизмов разработки молекулярных сигнальных систем и как индивидуализированные реакции на поведение могут быть применены в медицине и биотехнологии. Наконец, мы рассматриваем, как в будущем могут быть разработаны инструменты и методы, которые упростят разработку клеточного поведения.
Почему инженерная сигнализация ячейки?
Прежде чем рассматривать конкретные примеры сконструированных сигнальных путей, полезно обсудить мотивацию инженерии клеточной сигнализации.Попытка создать новое сигнальное поведение в клетках может показаться смелой и глупой целью, учитывая, что у нас еще нет полного или надежного предсказательного понимания естественных сигнальных цепей клеток. Однако разработка клеточной сигнализации — это не просто процесс применения уже хорошо разработанного понимания, но она предлагает подход к «пониманию через построение». В то время как биология традиционно была наукой анализа и деконструкции для выявления генов и молекул, которые важны для конкретного процесса, синтетическая биология предлагает обратный подход, фокусируясь на том, как отдельные молекулярные части могут быть собраны в системы, которые выполняют сложное поведение.Поскольку в настоящее время у нас есть полностью секвенированные геномы и огромное количество протеомных данных, нам не хватает не полного списка молекулярных частей, а скорее понимания того, как эти части сочетаются друг с другом функционально согласованным образом. Разработка новых сигнальных сетей клеток предлагает нам подход к тестированию и расширению нашего понимания принципов организации сложных молекулярных систем.
В этом смысле синтетическая биология передачи сигналов не просто ориентирована на достижение цели приложения, такой как построение клетки с целевой функцией, но также является исследовательской наукой, в которой важно понимать, какие конструкции «работают». и как они соотносятся с «неработающими» дизайнами.Если, например, у кого-то есть естественная сигнальная сеть, которая выполняет сложное представляющее интерес поведение, традиционная генетическая деконструкция может использоваться для идентификации молекул и связей, которые необходимы и важны для функции (). Однако затем можно использовать синтетические подходы для систематического изучения многих типов изменений — альтернативных сетевых связей, настройки силы связей, добавления новых связей — для проверки того, какие сети совместимы с этим интересующим поведением. Анализируя естественную сеть или проектируя единственную успешную схему, вряд ли можно получить более глубокое понимание функционального ландшафта, которое может дать более полное и систематическое исследование синтетической схемы () [3–5].В этом смысле попытки спроектировать клеточное поведение сродни ранней истории синтетической органической химии, где синтез новых или модифицированных молекул обеспечил дополнительный подход к химическому анализу в развитии фундаментальных теорий химической связи, структуры и реакционной способности [ 6]
Зачем менять схемы сигнальных цепей ячеек?и | понимание принципов дизайна. Традиционно для анализа сигнальной сети используются такие методы, как нарушение гена.Синтетические подходы предлагают дополнительную информацию, создавая альтернативные версии сети, которые различаются как подключением к сети, так и мощностью каналов. Сопоставляя пространство функциональных (красные кружки) и нефункциональных (синие кружки) вариантов, можно получить более глубокое понимание функциональных требований.
b | конструирует дизайнерские сигнальные пути для терапевтических или биотехнологических приложений. Мы надеемся собрать набор сигнальных модулей, которые можно использовать для создания ячеек со спроектированными сигнальными ответами.Противораковая клетка может обнаруживать комбинацию сигналов опухоли и давать такие ответы, как выработка реагентов для визуализации, уничтожение клеток или секреция факторов, нарушающих микросреду опухоли. Такая ячейка может также иметь предохранительные выключатели, которые могли бы отключить ячейку при необходимости. Иммуносупрессивная клетка может обнаруживать комбинацию аутоиммунного ответа или сигналов отторжения трансплантата и запускать локальные контрмеры, такие как секреция противовоспалительных цитокинов. Интеллектуальная биопродуктивная (ферментационная) клетка будет спроектирована так, чтобы точно модулировать поток роста по сравнению с производственными путями в ответ на стрессовое состояние клетки, тем самым оптимизируя общий урожай.
Изучение пластичности сигнальных путей и того, как их функции могут быть настроены, также имеет отношение к патологии и лечению заболеваний. Многие виды рака обладают онкогенными мутациями, которые эффективно «переплетают» сигнальные сети клеток, контролирующие баланс между ростом, дифференцировкой и гибелью клеток [7]. Точно так же многие внутриклеточные патогены, включая бактерии и вирусы, производят специфические белки, которые «переплетают» эндогенные сигнальные пути [7]. 8–10]. Многие белки бактериальных патогенов, которые взаимодействуют с клеточной сигнальной киназой и путями регуляции актина, часто для подавления иммунного ответа хозяина или усиления инфекции (см. Дополнительную вставку 1).Таким образом, используя синтетическую биологию для понимания пластичности путей и того, как их поведение изменяется из-за сетевых возмущений, мы можем получить лучшую основу для понимания стратегий, которые патоген принимает для использования внутренней уязвимости сигнальных сетей. Более того, мы можем разработать стратегии для возврата больной сети к стабильному, непатологическому поведению. Наиболее стабильные методы лечения на основе сети могут включать не просто блокировку первичного онкогенного белка лекарством, а изменение структуры сети таким образом, чтобы она располагалась в новой и стабильной области поведенческого пространства.
Применение инженерной передачи сигналов в терапии и биотехнологии
Еще одним мотивом для разработки сигнального поведения клеток является возможность конструирования клеток, запрограммированных для выполнения точно разработанных приложений (). Представьте себе, если бы мы могли имитировать и превзойти эволюцию, используя набор молекулярных компонентов для генетической инженерии клеток, которые выполняют индивидуально разработанные реакции. По мере развития биологии стволовых клеток [11–12] и развития таких методов, как адоптивная иммунотерапия [13–14], возможность использования клеточной терапии становится все ближе, но это потребует сложной клеточной инженерии для точного контроля поведения клеток.Например, без нового контроля, как может быть направлена правильная миграция и дифференцировка стволовых клеток для регенеративной медицины при отсутствии нормальных сигналов развития? Более того, по мере того, как все больше промышленных производственных процессов задействуют биологические организмы (такие как производство биотоплива или материалов) [15], может появиться возможность разработать более разумные производственные штаммы, которые, как и макроскопические производственные объекты, будут иметь системы клеточного контроля, которые отслеживают внешние и внутренние состояния для оптимизации производство.Это может быть особенно важно, поскольку мы просим ферментирующие организмы, такие как дрожжи, производить широкий спектр материалов, которые могут оказывать токсическое действие.
Разработанные противораковые клетки
Если мы сосредоточимся на разработке индивидуальных терапевтических клеток, которые могут воспринимать сигналы болезни и выполнять целенаправленные и точно откалиброванные терапевтические программы, какое поведение мы хотели бы? Иммунные клетки, такие как Т-лимфоциты или естественные клетки-киллеры, можно модифицировать для идентификации и уничтожения опухолевых клеток.Такие клетки уже можно удалить у пациентов, генетически модифицировать, размножить ex vivo и адаптивно перенести обратно пациенту [16-17]. Противораковая клетка может быть разработана для обнаружения комбинации сигналов, связанных с опухолью, включая специфические опухолевые антигены, гипоксию, органоспецифические антигены, а также специфические факторы роста и цитокины, которые секретируются опухолями, чтобы избежать нормальных иммунных ответов и создать микроокружение, способствующее развитию опухолей [18],. Инженерные клетки, которые распознают эти факторы, но связаны с противоопухолевым ответом, были бы идеальными.Также критически важно разработать внешний контроль (например, небольшую молекулу) или предохранительные переключатели для этих терапевтических клеток, чтобы их поведение можно было отключить или ослабить в ответ на нежелательные побочные эффекты, или чтобы титровать величину их реакции.
Сконструированные клетки, которые обнаруживают эти специфические для опухоли входные данные, могут быть сконструированы для получения ряда различных ответов, таких как производство агентов визуализации, которые помогают в идентификации опухолей и метастазов, и контроль эндогенных иммунных клеточных реакций, таких как хемотаксис, фагоцитоз и убийство клеток.Возможно, наиболее важно то, что эти терапевтические клетки могут быть запрограммированы на секретирование факторов, нарушающих локальное микроокружение опухоли, таких как провоспалительные цитокины и факторы антиангиогенеза, что делает их непригодными для устойчивого роста опухоли. Это было бы эквивалентно созданию специальной иммунной клетки, которая выводит из строя опухолевые клетки и микроокружение на нескольких уровнях.
Направленная иммуносупрессия
Иммунная клетка также может быть разработана для блокирования аутоиммунного заболевания или отторжения трансплантированных органов.Обычная иммуносупрессивная лекарственная терапия имеет широкие и серьезные системные эффекты. Сконструированная клетка может быть запрограммирована на местную иммуносупрессивную реакцию, возможно, в ответ на специфические аутоиммунные антигены или антигены трансплантата в сочетании с цитокиновыми сигнатурами сильного аутоиммунного ответа. Такие клетки могут быть запрограммированы на хемотаксис к участкам этих сигналов и реагировать путем секреции противовоспалительных цитокинов, которые отключили бы воспалительные петли положительной обратной связи, которые обычно приводили бы к полномасштабной аутоиммунной реакции или реакции отторжения.
Хотя индивидуально разработанные терапевтические клетки — это будущее, полезно подумать о том, какое поведение обнаружения и реакции будет ценным, так как они обеспечивают полезные целевые вехи в разработке инструментов и стратегий для перестройки клеток.
Можно ли проектировать сети передачи сигналов сотовой связи?
Существуют большие разногласия относительно того, действительно ли элементы можно спроектировать. Системы клеточной сигнализации настолько тонко оптимизированы, что наше вмешательство приведет к катастрофическим сбоям, или настолько надежно спроектированы эволюцией, что добавление новых генов и сетевых связей не сможет существенно изменить функцию? Очевидно, что эволюция смогла перестроить клеточные сигнальные пути, чтобы получить разнообразные ответы — на определенном уровне они относительно пластичны и эволюционируют.Таким образом, прежде чем пытаться создать новое клеточное поведение, может быть поучительно подумать о том, как эволюция может достичь инновационных новых функций.
Отличительной чертой сигнальных белков, которая, как полагают, играет важную роль в эволюции, является их модульная структура. Они почти всегда состоят из множества модульных доменов, некоторые из которых выполняют каталитическую функцию, а многие — специфические регуляторные функции или функции взаимодействия [19, 20]. Эти модульные домены встречаются в различных сигнальных белках в самых разных комбинациях.Это привело к модели, согласно которой разнообразие сигнальных функций может развиваться посредством рекомбинации этого набора доменов. Таким образом, в принципе, если бы мы могли понять, как эволюция работает с этими модулями, мы могли бы использовать тот же набор инструментов, чтобы найти области пространства поведения, которые эволюция, насколько нам известно, еще не исследовала.
Почему сигнальные белки и системы настолько модульны? Большинство согласны с тем, что в эволюционной временной шкале организмы находятся под давлением приспособленности к развитию инновационных клеточных сигнальных реакций, которые могут привести к преимуществам в изменяющейся окружающей среде и по сравнению с конкурирующими организмами.Под воздействием такого рода изменяющегося давления приспособленности модульные системы могут спонтанно развиваться как способ облегчить более быструю диверсификацию функций [21]. Алон и его сотрудники смоделировали эволюцию биологической сети, используя эволюционные алгоритмы для поиска простых вычислительных сетей, которые решают поставленную цель [22]. Когда они неоднократно меняют целевую цель, результирующие сети спонтанно развивают более модульные решения — сети, которые имеют внутри себя функциональные подсети. Эти заранее сформированные подсети — модули — могут быть быстро переподключены новыми способами для перехода от одной целевой функции к другой.По сути, кажется, что модули предоставляют способ быстро перемещаться из одного функционального пространства в другое, перепрыгивая через обширные области нефункционального сетевого пространства. Таким образом, модульная организация сигнальных белков и сетей может отражать давление на эти системы с целью создания поведения, которое соответствует потребностям постоянно меняющейся среды.
Важность модульности в облегчении эволюции новых функций согласуется с концепциями эволюции и развития, в которых утверждается, что большая часть диверсификации функций и морфологии организмов эволюционирует через альтернативное регулирование существующих компонентов, а не на изобретение принципиально новых компонентов [23].Хотя многие из этих идей были разработаны с упором в первую очередь на регуляцию генов с помощью различных цис-действующих модулей, они также могут применяться к регуляции ключевых каталитических сигнальных модулей с помощью разнообразных локализационных и регуляторных модулей [24,25]. Неудивительно, что многие из усилий по разработке нового сигнального поведения, описанного ниже, используют стратегии рекомбинации модульных функциональных единиц новыми способами, таким образом, по сути, используя эволюционную стратегию для создания новой функции.
Разработка новых сенсорных систем
Одним из наиболее важных инструментов для изменения поведения клеток будет способность создавать новые датчики и рецепторы для целевых входов.Однако это, пожалуй, наименее охарактеризованный элемент в инженерии клеточной сигнализации, потому что вселенная возможных входов настолько обширна и часто включает проблему работы с относительно сложными мембранно-ассоциированными мембранными белками. Ниже мы описываем недавний прогресс в модификации или конструировании различных рецепторных молекул.
Перенаправление выхода естественных рецепторов
Природные рецепторы, которые обнаруживают специфические эндогенные входы, могут быть спроектированы для генерации неродной выходной реакции.Есть несколько примеров перенаправления нативного рецептора, чтобы вызвать новый транскрипционный ответ. Один из таких подходов использует модульную структуру рецепторного белка Notch. Notch — это трансмембранный рецептор, который обнаруживает белок Delta, присутствующий на соседних клетках, — критический канал межклеточной коммуникации в развитии и дифференцировке. Когда Delta связывает Notch, трансмембранная область Notch расщепляется мембранной протеазой, высвобождая C-концевой домен Notch в цитоплазму.Этот домен может проникать в ядро и активировать транскрипцию гена. Struhl et al. Показали, что этот модуль фактора транскрипции рецептора notch может быть заменен синтетическим фактором транскрипции (Gal4-AD), так что при активации in vivo этот химерный рецептор notch может активировать гены, нацеленные на новый фактор транскрипции [26 , 27]. Хотя эту конструкцию использовали в качестве репортера для активации Notch, ее можно было легко использовать для связывания обнаружения нативного дельта-лиганда с совершенно новым набором ненативных генов-мишеней.
Barnea et al. Расширили эту модульную стратегию, вдохновленную Notch, путем создания новых транскрипционных выходов для других рецепторов, которые обычно не используют этот тип механизма активации протеаз [28]. Когда рецепторы, сопряженные с G-белком (GPCR), активируются своими специфическими лигандами, они часто рекрутируют β-аррестин, который участвует в подавлении передачи сигналов GPCR. Barnea et al. Слили аррестин с высокоспецифичной протеазой вируса травления табака (TEV), так что он был совместно задействован в активированных GPCR.Синтетический фактор транскрипции также был слит с цитоплазматическим хвостом GPCR, связанным сайтом расщепления TEV. Таким образом, когда сконструированный слитый белок GPCR активируется своим эндогенным лигандом, он рекрутирует партнера протеазы аррестин-TEV, который расщепляет и высвобождает домен фактора транскрипции из GPCR, посредством чего он может проникать в нуклеазу и активировать гены-мишени. Эта система успешно использовалась для связывания новых репортеров транскрипции с активацией широкого спектра специфических GPCR.Ответ очень специфичен благодаря специфичности расщепления TEV. В принципе, эту стратегию можно использовать для связывания любого эндогенного сигнала, опосредованного GPCR, с экспрессией желаемых генов-мишеней.
Barnea et al. Также использовали эту стратегию для связывания передачи сигналов эндогенной рецепторной тирозинкиназы (RTK) с новыми выходами транскрипции [28]. Большинство RTK при стимуляции активируют свои киназные домены, которые опосредуют аутофосфорилирование цитоплазматических тирозинов для рекрутирования белков, содержащих домен Sh3.Здесь протеаза TEV была слита с рекрутированными доменами Sh3, а синтетический фактор транскрипции был слит с цитоплазматическим хвостом RTK через сайт расщепления протеазой TEV. Итак, активация RTK ведет к рекрутированию слияния Sh3-домен-TEV, высвобождению ассоциированного с рецептором фактора транскрипции и транскрипции гена инженерии. Примечательно, что эта простая модульная стратегия может быть применена к нескольким классам рецепторов, если они привлекают определенный белок-партнер при активации.
Howard et al. Использовали модульность передачи сигналов RTK для перенаправления сигнала онкогенного роста на апоптотический ответ [29]. Они сконструировали новый адаптерный белок Sh3, в котором домен Sh3, распознающий активированный RTK, был слит с доменом эффектора смерти от Fadd. Таким образом, активация RTK привела к рекрутированию в мембрану домена смерти, что вызвало ответ клеточной смерти. Возможность увязки других новых результатов с этими ключевыми событиями найма еще недостаточно изучена.
Рецепторы, которые обнаруживают новые входные данные малых молекул
Вышеупомянутые стратегии сосредоточены на способах получения рецепторов, которые обнаруживают эндогенные сигнальные молекулы, и конструируют их так, чтобы вызывать новые ответы. Однако во многих случаях для клеточной инженерии могут потребоваться рецепторы, которые обнаруживают новые сигналы, для которых нет эндогенных рецепторов. Эти новые сигналы включают в себя небольшие молекулы, которые мы можем захотеть обеспечить внешнее управление инженерной системой.
Относительно хорошие успехи были достигнуты в использовании GPCR в качестве платформы для конструирования контролируемых рецепторов на малых молекулах.Некоторые GPCR, такие как опиоидные рецепторы, могут активироваться их эндогенными лигандами и специфическими низкомолекулярными агонистами. Конклин, Рот и его сотрудники сконструировали молекулы, известные как рецепторы, активируемые исключительно синтетическими лигандами (RASSL) [30,32]. Эти рецепторы мутированы так, что они не могут связывать свой эндогенный лиганд, но активируются и вызывают свой эндогенный нисходящий эффект в ответ на небольшой фармакологически инертный молекулярный агонист.
GPCR различаются по своим выходам, отчасти потому, что отдельные рецепторы связываются со специфическими гетеротримерными G-белками.Дальнейшая разработка дала версии RASSL, которые специфически связаны с каждым из этих отдельных нисходящих путей, тем самым позволяя малым молекулам контролировать очень разнообразный набор выходов. Эти RASSL были успешно применены у трансгенных мышей — по сути, перестраивая передачу сигналов в полноценном живом организме — в основном в качестве диагностического и аналитического инструмента. Применение было разнообразным, учитывая широкое использование GPCR в разных тканях. Например, мыши, несущие вкусовые нейроны, экспрессирующие RASSL, проявляли специфические сладкие (привлекательные) или горькие (аверсивные) ответы на воду, смешанную с агонистом (спирадолином), в зависимости от того, в каком типе нейрона они экспрессировались [33].Кроме того, экспрессия RASSL в клетках сердца позволяет контролировать частоту сердечных сокращений путем введения спирадолина [34]. То, что эти рецепторы in vivo так надежно работают, , намекает на их потенциальную полезность в более сложной клеточной инженерии.
Химические димеризаторы образуют другую стратегию достижения контроля малых молекул над передачей сигналов. Такие стратегии были рассмотрены в другом месте [35,36] и не будут здесь обсуждаться.
Рецепторы, которые обнаруживают определенные пользователем антигены
Было бы идеально разработать рецепторы, которые могут воспринимать ассоциированные с заболеванием антигены, такие как белок, сильно экспрессирующийся в опухоли или инфекционном агенте.Если бы рецепторы могли быть сконструированы для достижения такого же разнообразия и избирательности распознавания, что и антитела, можно было бы обнаруживать широкий спектр входных сигналов и связывать их с конкретными ответами. Химерные антигенные рецепторы (CAR) — рецепторы, созданные с использованием одноцепочечных антител (scFv) как часть механизма их обнаружения, — были разработаны как универсальный каркас этого типа. Эта стратегия проистекает из модульности рецепторов иммунных клеток, таких как рецептор Т-клеток. Хотя Т-клеточный рецептор представляет собой сложный мультибелковый комплекс, сшивания цитоплазматической области субъединицы дзета-цепи CD3 достаточно для индукции передачи сигналов Т-клетками [37].Дзета-цепь CD3 содержит мотивы, которые фосфорилируются при активации тирозинкиназами, такими как Lck, для индукции рекрутирования белков, содержащих домен Sh3, таких как киназа ZAP-70. Слияние цитоплазматической области дзета-цепи CD3 с внеклеточным одноцепочечным антителом (scFv) дает рецептор, часто называемый «Т-тельцем», который при экспрессии в Т-клетках приводит к целенаправленному уничтожению клеток, экспрессирующих узнаваемый антиген (предположительно, поверхностные антигены сшивают и активируют химерные рецепторы) [38,39].Слияние scFv с внутриклеточной областью рецептора Fc (гамма-цепь) может дать химерный антиген-чувствительный рецептор аналогичного типа. Эти исследования подчеркивают модульность этих рецепторов: соединение нового внеклеточного распознающего элемента с нижележащими внутриклеточными сигнальными элементами приводит к новому датчику ввода / вывода.
Эти CAR первого поколения относительно примитивны и дали неоднозначные результаты. Т-клетки, экспрессирующие CAR, направленные против опухолевых антигенов, обладают умеренной сигнальной способностью по сравнению с эндогенными ответами TCR, умеренно пролиферируют ex vivo и in vivo и имеют низкую выживаемость при многократном воздействии антигена [16,17]].Улучшения в этом поведении были сделаны путем включения дополнительных модульных доменов во внутриклеточные области CARs, включая домены от молекул корецепторов, которые являются частью нормальной активации TCR, таким образом, возможно, имитируя более полную активированную внутриклеточную сборку [40,41]. Клетки, содержащие CAR следующего поколения, более эффективно контролируют опухоли ксенотрансплантата у мышей, и в настоящее время переносятся на клинические испытания [16]. Более сложная инженерия CAR может привести к еще большему улучшению терапевтической функции.
Датчики, которые обнаруживают физические сигналы, такие как свет
Еще одна интересная область исследований — разработка генетически закодированных датчиков, которые могут обнаруживать свет и преобразовывать его в конкретный биологический ответ, область, называемая оптогенетикой. Встречающиеся в природе светочувствительные белки растений, водорослей и бактерий можно модифицировать для использования в высших организмах, включая млекопитающих. Эти инструменты чрезвычайно полезны в качестве пространственно-временных шкал для контроля и анализа сложного клеточного и организменного поведения, особенно когда они экспрессируются с помощью промоторов, специфичных для клеточного типа.В долгосрочной перспективе оптогенетические инструменты могут использоваться для удаленного контроля клеток, используемых в терапевтических целях, хотя существуют серьезные технические проблемы, такие как то, как свет может доставляться в организм, которые необходимо будет преодолеть. Наиболее часто используемые сегодня оптогенетические инструменты — это белки микробного канала родопсин и галородопсин, которые широко используются для контроля функции нейронов. Они рассмотрены в другом месте [42] и не будут здесь подробно обсуждаться.
Совсем недавно появились дополнительные оптогенетические инструменты, которые могут быть применены к более широкому спектру клеточных сигнальных систем.Airan et al. Сконструировали набор активируемых светом GPCRs, которые могут связываться как с нижележащими Gs, так и с гетеротримерными G-белками Gq [43]. Были созданы химеры светочувствительной зрительной системы GPCR, родопсин (бычий), которые содержат внутриклеточные петли от Gq- и Gs-сопряженных адренергических рецепторов. Эндогенная молекула сетчатки — это светочувствительный хромофор. Эти новые инструменты значительно расширяют «словарь» передачи сигналов, которым можно управлять с помощью света, учитывая важность путей передачи сигналов Gq и Gs в различных типах клеток.
Еще более обобщенная стратегия управления светом включает использование контролируемых светом белковых взаимодействий. Временное взаимодействие конкретных белков-партнеров является основой многих внутриклеточных сигнальных событий (см. Ниже), и рецепторы могут быть обойдены, так что свет напрямую контролирует такие внутриклеточные взаимодействия. Левская и др. Использовали систему взаимодействия фитохрома, полученную из растений — связывание этого фоторецептора с его партнерским доменом PIF может включаться и выключаться с помощью определенных длин волн света — для рекрутирования определенных белков на мембрану точным пространственно-временным образом [44].В случае факторов обмена гуаниновых нуклеотидов (GEF), которые контролируют GTPases семейства Rho, это может быть использовано для запуска активации GTPase и последующих изменений цитоскелета, приводящих к световодному выпячиванию клеток. Хотя этот метод является мощным и потенциально применимым ко многим сигнальным взаимодействиям, система Phy-PIF требует добавления проницаемого для клетки хромофора, который не является эндогенным для клеток млекопитающих. Wu et al. Использовали светочувствительный домен LOV (свет-кислород-напряжение) (обнаруженный в растениях, водорослях и бактериях) для конформационной закупорки Rac GTPase контролируемым светом способом [45].Этот связывающий флавин домен обеспечивает еще один потенциально общий конформационный элемент управления светом, который может быть связан для управления различными сигнальными белками.
Инженерные системы обработки сигналов
В конечном итоге клетки решают, какие программы ответа выполнять на основе внутриклеточных сигнальных сетей, которые принимают и обрабатывают сигналы от сенсорных молекул (см. Выше). Недавняя работа в области сотовой инженерии была сосредоточена на понимании того, как эти сети функционируют для принятия решений и как их можно изменить.
Модульная логика обработки сигналов
Внутриклеточные сигнальные белки имеют высокую модульность (см. Выше). Большинство модулей делятся на два класса (). Первый класс — это ферментные домены, такие как киназы и фосфатазы, которые катализируют посттрансляционные модификации или конформационные изменения, с помощью которых сохраняется информация. В большинстве случаев эти каталитические домены входят в пары: ферменты-писатели (например, киназы) производят модификацию, а ферменты-стиратели (например, фосфатазы) удаляют модификацию.Второй класс — это регуляторные домены или домены взаимодействия, которые модулируют активность каталитических доменов или нацеливают их на конкретных партнеров или сайты в клетке. Эти модули могут опосредовать специфические белок-белковые взаимодействия (либо конститутивные взаимодействия, либо те, которые зависят от посттрансляционных модификаций, таких как фосфорилирование) или белок-мембранные взаимодействия. Таким образом, именно регуляторные домены и домены взаимодействия определяют, когда и где активируются каталитические домены и каким партнерам они передают информацию [5].
Модульная логика компонентов внутриклеточной сигнализацииa | ферментных и регуляторных доменов . Модульные сигнальные белки эукариот обычно состоят из ферментативных доменов и доменов локализации. Ферментные домены, такие как киназы и фосфатазы, а также GEF и GAP, катализируют регуляторные модификации, такие как фосфорилирование и активация GTPase, соответственно (ферментные домены часто входят в пары «писатель» и «стиратель», которые имеют противоположные активности).Эти ферментные домены регулируются и нацелены на домены взаимодействия, включая домены межбелкового взаимодействия, домены мембранного взаимодействия или трансмембранные домены.
b | различных классов многодоменных архитектур . Ферментативные домены могут быть непосредственно нацелены на определенные субстраты, партнеров или субклеточные участки посредством доменов взаимодействия. В качестве альтернативы они могут быть косвенно нацелены через адаптеры или белки каркаса, которые содержат несколько доменов взаимодействия.Домены взаимодействия могут также аллостерически регулировать каталитические домены, участвуя во внутримолекулярных аутоингибиторных взаимодействиях. Такие переключающие белки могут быть активированы конкурирующими лигандами, которые снимают аутоингибирование.
Эти разные классы модулей обнаруживаются в различных комбинациях и расположениях в сигнальных белках (). Каталитические домены, слитые с нацеливающими доменами, могут быть задействованы в определенных комплексах или участках мембраны, где они будут модифицировать определенные мишени; часто эти каталитические домены имеют высокую внутреннюю константу Михаэлиса (Km’s и, следовательно, требуют нацеливания с помощью дополнительных доменов взаимодействия для эффективного катализа.Иногда эти нацеленные взаимодействия регулируются, если, например, взаимодействие зависит от посттрансляционной модификации, такой как нацеливание белков домена Sh3 на аутофосфорилированные сайты pTyr на активированных RTK. Белки с двумя доменами взаимодействия могут действовать как адаптеры, которые переводят одно взаимодействие во второе, что приводит к увеличению гибкости ответа в зависимости от адаптерных белков, которые экспрессируются в конкретном типе клеток. Белки с множественными доменами взаимодействия могут также функционировать как скаффолдные белки, которые организуют несколько белков на пути в комплекс.Эти взаимодействия могут быть конститутивными или предопределенными, или индуцированными такими факторами, как фосфорилирование или конформационные изменения, которые открывают сайты взаимодействия. Таким образом, каркасные белки могут в принципе определять проводные связи сигнальных белков, а также контролировать, когда и где происходит передача сигналов [24, 20].
Вторая важная роль взаимодействия и регуляторных доменов — это непосредственный контроль активности каталитических доменов. Во многих случаях домены взаимодействия участвуют во внутримолекулярных аутоингибиторных взаимодействиях, которые стерически закрывают каталитический домен или конформационно возмущают его — тип регуляции, называемый модульной аллостерией [46].Связывание конкурирующих межмолекулярных лигандов с доменами взаимодействия индуцирует каталитическую активность белков. Часто множественные домены взаимодействия участвуют в автоингибировании каталитического домена кооперативным или иерархическим образом [47, 48]. Эти белки могут функционировать как сложные переключатели с множеством входов, которые требуют определенной комбинации входов для правильной активации. Кроме того, поскольку внешние лиганды активируют эти белки, локализация (управляемая этими взаимодействиями) может быть напрямую связана с активацией.
Разработка новых белковых переключателей
Лим и его сотрудники исследовали, можно ли использовать модульную аллостерическую логику многих природных эукариотических сигнальных белков для создания новых сигнальных переключателей путем рекомбинации доменов (). В самом деле, каталитические домены актинового регуляторного белка N-WASP и GEF семейства Rho могут быть связаны с новыми аутоингибиторными доменами с образованием белков, активность которых регулируется новыми лигандами [49,50]. Внутримолекулярное связывание любого из этих каталитических доменов с доменом PDZ и пептидом лиганда PDZ может давать переключатель, который активируется конкурирующим пептидом PDZ.Точно так же можно добавить несколько доменов взаимодействия, чтобы получить комбинаторный переключатель, отображающий управление логическим элементом И. В зависимости от точной конфигурации доменов и внутримолекулярных взаимодействий типы регуляции могут быть разными в ответ на разные конкурирующие внешние лиганды — один лиганд может активировать белок, а другой репрессировать его. Эти типы разнообразных взаимоотношений между регуляторными доменами напоминают разнообразное поведение, наблюдаемое в природных сигнальных белках, подтверждая представление о том, что этот вид архитектуры переключения облегчает эволюцию разнообразных комбинаторных регуляторных переключателей [48].Dueber et al. Также показали, что синтетические аутоингибирующие переключатели, использующие поливалентные взаимодействия одного и того же типа, приводят к переключениям, поведение активации которых может быть настроено кооперативно от линейного до цифрового ответа [51].
Инженерные схемы обработки сигналовa | инженерных переключателей аллостерических белков . Dueber et al [49,51] показали, что аллостерическая регуляция сигнального белка N-WASP может быть перепрограммирована путем рекомбинации каталитического домена из N-WASP с различными комбинациями доменов взаимодействия.Новые модели поведения включали управление с множеством входов (логический элемент И) и активную активацию, подобную переключателю.
b | с использованием белков каркаса в качестве молекулярной печатной платы для преобразования выходных сигналов . Связь входа / выхода киназного пути MAP в дрожжах может быть перенаправлена через сконструированный химерный каркас, который собирает новую комбинацию киназ [58]. Новые сайты взаимодействия также могут быть добавлены к каркасам для привлечения дополнительных модулирующих факторов.Эти дополнительные факторы могут быть построены синтетическими петлями обратной связи, которые могут быть использованы для создания путей, которые отображают разнообразную динамику передачи сигналов [62].
Каркасные белки как молекулярные схемы
Цепи внутриклеточной передачи сигналов также можно напрямую контролировать, используя регуляторные взаимодействия для перепрограммирования соединений путей. Например, каталитический домен киназы семейства Src, Hck, который обычно регулируется доменами Sh3 и Sh4, может быть слит с доменом PDZ и направлен in vivo для специфического фосфорилирования субстратов с мотивом лиганда PDZ [52].
Белки каркаса также могут быть использованы для создания новых взаимосвязей между входом и выходом пути. У дрожжей существует множество функционально различных киназных путей митоген-активированного протеина (MAP), которые регулируют ответы на феромон спаривания и осмотический стресс [53,54]. Эти пути имеют общие компоненты киназ, но остаются специфическими, потому что каждый путь организован отдельным каркасным белком [55–57]. Химерный каркасный белок, который организует избранных членов путей спаривания и осмотического стресса, дает неприродный путь, в котором феромон спаривания специфически индуцирует программу реакции осмостресса в vivo [58].Подобные ковалентные слияния, которые, подобно каркасу, вызывают взаимодействие между двумя сигнальными белками, могут быть использованы для принудительной передачи сигнала по единственному пути [59].
Совсем недавно было показано, что каркасные белки не только опосредуют линейные отношения ввода / вывода путей, но также координируют набор модуляторных факторов, которые формируют дозовую зависимость и динамику ответа пути [60,61]. Вдохновленный этими природными примерами, Башор и др. Показали, что дрожжевой скаффолд MAP-киназы, белок Ste5, можно использовать в качестве молекулярной печатной платы, чтобы гибко изменять количественное поведение реакции спаривания [62].Слияние дополнительного сайта синтетического взаимодействия с каркасом Ste5 (с использованием пары гетеродимеров лейциновой застежки) способствует привлечению новых модулирующих факторов, таких как фосфатаза MAPK, которая подавляет ответ пути. Однако, если экспрессия и рекрутирование фосфатазы связаны с выходным сигналом пути, возникает петля отрицательной обратной связи, которая приводит к адаптации — временный ответ, за которым следует автоматический возврат к более низким уровням выхода, что является ключевым поведением во многих биологических сенсорных системах.Связывая по-разному положительные и отрицательные модуляторы пути, этот небольшой набор элементов управления каркасом может быть использован для генерации очень разнообразных дозовых реакций и динамического поведения, включая высоко кооперативное переключение, отложенные ответы, ускоренные ответы и генерацию импульсов. Эти исследования показывают, как организующие центры, такие как каркас, являются богатой платформой для обработки и формирования внутриклеточной передачи сигналов посредством эволюции или инженерии.
Инженерная пространственная самоорганизация
Один из наиболее плохо изученных аспектов передачи сигналов в клетке — это то, как контуры, состоящие из диффундирующих молекул, могут приводить к высокоточной пространственной организации в клетке, такой как направленная поляризация и миграция.Этот тип самоорганизации является аспектом схемы управления, где нет хороших электронных или инженерных аналогов, и где биология может обучать инженерии.
Инженерные принципы применяются для понимания механизма поляризации почкующихся дрожжей, S. cerevisae . Поляризация контролируется GTPase Cdc42, которая в конечном итоге локализуется в одном сайте материнской клетки, приводя к образованию единственной почки, которая врастает в дочернюю клетку [63].Примечательно, что этот процесс приводит к образованию единственной бутоны почти со 100% надежностью. Цепь положительной обратной связи с участием Cdc42 GTPase является ключевой в поляризации: активный Cdc42 на мембране рекрутирует цитоплазматический белок GEF Bem1, который активирует и локализует дополнительный Cdc42 [64]. Хотя этот вид петли обратной связи ведет к образованию фокусов Cdc42, быстрая диффузия и перераспределение Bem1 между конкурирующими фокусами может быть важным, чтобы позволить одному из фокусов стать доминирующим, что ведет к сингулярности почкования.Эффект замедления диффузии и перераспределения Bem1 за счет связывания его с трансмембранным мотивом был проанализирован [65]. Bem1, привязанный к мембране, может спасти летальность от нокаута Bem1, но не может подвергаться диффузии в цитоплазме. Вместо этого он доставлялся к плазматической мембране в везикулах через актиновые кабели (также координируемые фокусами Cdc42) и от мембранных фокусов посредством эндоцитоза и, таким образом, перераспределялся намного медленнее. Наблюдались серьезные дефекты сингулярности, такие как множество устойчивых конкурирующих фокусов Cdc42, и частота многопочкованных клеток увеличивалась до ~ 5%.Подобные исследования помогают выявить требования к точно контролируемой пространственной самоорганизации и предполагают, что мы можем научиться создавать сигнальные цепи, которые производят индивидуальные пространственные результаты с важным терапевтическим поведением (например, регенеративная медицина, которая требует определенной клеточной морфологии и ориентации).
Создание предсказуемой инженерии передачи сигналов
Исследования, приведенные выше, показывают, что сигнальные системы являются высокомодульными и пластичными и рекомбинирующие модули, особенно каталитические домены с новыми регуляторными доменами, могут приводить к отличному ответному поведению.Таким образом, вопрос уже не в том, можно ли спроектировать сигнальные системы для получения нового поведения, а в том, можно ли их спроектировать таким образом, чтобы мы могли предсказать, какое поведение проявится и насколько успешной будет каждая спроектированная схема.
Проблема непредвиденных перекрестных помех
Одна из основных проблем, связанных с передачей сигналов инженерной клетки, заключается в том, что естественные компоненты — инструментарий доступных доменов — повторно используются, что может привести к непредвиденным перекрестным помехам. Приведут ли инженерные взаимодействия, которые вы создаете, к специфическому фосфорилированию желаемого белка, или используемый домен также будет перекрестно взаимодействовать с другими мишенями, конкурентно титруя важные физиологические взаимодействия и приводя к непредвиденным эффектам или сбоям в спроектированной схеме? Часто природные части не обладают абсолютной специфичностью, и эволюция, скорее всего, использует сложные сети перекрестной реактивности, чтобы обеспечить важную скоординированную регуляцию.Хотя такая сложная система, похожая на нейронную сеть, может обеспечить преимущества для клетки, это проклятие для прогнозной инженерии.
Представляя будущий инструментарий сигнализации
Одним из решений этой проблемы является сборка инструментария из деталей, специально оптимизированных для проектирования. Этот вопрос важен для любого типа сигнальной части, но мы сосредоточимся на том, как собрать полезный инструментарий из частей, взаимодействующих с белками ().
Улучшение инструментария для предсказуемой инженерии клеточной сигнализации: части ортогонального взаимодействияНативная клетка имеет свой собственный репетитор модулей взаимодействия с белками, и поэтому сложно разработать новые функции с использованием связанных модулей взаимодействия, которые могут показывать непреднамеренные и непреднамеренные перекрестные помехи в камере.Оптимизированный набор взаимодействующих частей может значительно повысить предсказуемость клеточной инженерии, исключив возможность непреднамеренных перекрестных помех. Несколько стратегий оптимизации включают разработку модулей взаимодействия, которые используют неиспользованную специфичность; разработка составных, многодоменных взаимодействий; объединение модулей взаимодействия с новым субклеточным нацеливанием; и импорт модулей ортогонального взаимодействия (либо созданных синтетически, либо из других организмов), которых нет в клетке-хозяине.
Хотя природа неоднократно использовала семейства частей, такие как домены взаимодействия определенного типа, недавние исследования показывают, что в некоторых случаях члены семейства содержат неиспользуемые сайты узнавания внутри этих доменов. Их можно использовать для создания пар домен-пептид, которые одновременно оптимизированы для взаимодействия со своим правильным партнером, избегая при этом перекрестного взаимодействия с другими членами семейства [66,67]. Фактически были сконструированы пары PDZ-домен-лиганд и гетеродимеризующиеся пары лейциновой застежки-молнии, которые оптимизированы, чтобы избежать перекрестной реакции с естественными доменами того же типа [68,69].Избирательность и предсказуемость существующих доменов взаимодействия также можно улучшить путем разработки составных взаимодействий. Конечно, многодоменное сотрудничество — естественный механизм повышения специфичности. Но новый поворот в этом вопросе — это разработка составных двухкомпонентных взаимодействий типа «раскладушка». Koide et al. Взяли домен PDZ и слили его с доменом фибронектина [70]. Используя фаговый дисплей, они отобрали варианты этого тандемного домена, которые связывают определенный пептид, так что он находится между двумя доменами.Резко увеличенная площадь распознавания приводит к взаимодействиям с гораздо более высокой специфичностью и сродством. Другое решение для специфичности, которое наблюдается в природе, — это дифференциальная компартментализация. Если нацеливающие мотивы могут быть использованы для локализации партнерских белков в определенных органеллах или клеточных участках, то мотивы взаимодействия, вероятно, будут функционировать более специфическим образом, особенно если в этом месте или органелле происходит мало или совсем не происходит конкурирующих взаимодействий этого типа.
Альтернативный подход к достижению надежной специфичности заключается в импорте доменов из других организмов, которых нет в создаваемом хозяине. Напр., PDZ домены могут быть импортированы в дрожжи (у которых отсутствует большинство таких доменов), хотя возможность случайных перекрестных реагирующих партнеров не может быть исключена [58]. Примером ортогональной молекулярной системы, которая была успешно перенесена на нового хозяина, является бактериальная рекомбиназная система Cre-Lox, которая надежно используется для создания сложных хромосомных перестроек в сложных организмах, включая мышей [71].
Таким образом, представляя инструментарий будущего, можно захотеть создать набор из десяти или около того пар взаимодействия белков, оптимизированных для конкретного выбранного организма (например, E.coli , S.cerevisae , млекопитающие) в том, что они ортогональны, то есть известно, что они не реагируют перекрестно с протеомом хозяина или белками в наборе инструментов, за исключением их родственного лиганда. Также важно, чтобы эти взаимодействия были настраиваемыми, поэтому серия лигандов для каждого домена взаимодействия, которые различаются по аффинности на несколько порядков, были бы идеальными.Это позволило бы систематически исследовать, как сродство вербовки меняет поведение системы.
Комбинаторный дизайн и прогнозирование
Другой другой, но все же дополнительный подход к предсказуемому проектированию передачи сигналов соты состоит в использовании комбинаторной изменчивости. В ходе естественной эволюции рекомбинация сигнальных модулей для генерации новой функции, по-видимому, не была спроектирована или направлена, а скорее была относительно случайной, и именно естественный отбор выявил события перепрограммирования, которые привели к преимуществам приспособленности.Таким образом, очень плодотворным подходом, учитывая отсутствие предсказуемости в клеточной инженерии, могло бы быть построение комбинаторных библиотек синтетических схем и выбор желаемой функции [25,72]. Более того, этот подход можно было бы комбинировать с полу- прогнозное проектирование, при котором могут быть разработаны общие архитектуры спроектированных схем, но комбинаторные методы используются для поиска в более широком диапазоне пространства параметров (с использованием вариантов каждого модуля в библиотеке). Сосредоточение внимания на комбинаторном выборе может также обеспечить очень полезную стратегию на заре синтетической биологии, поскольку это может помочь нам быстрее узнать о основных принципах проектирования.
Outlook
Цель понимания того, как клетки общаются и принимают решения, остается очень привлекательной, особенно потому, что понимание молекулярного языка внутри клетки может позволить нам общаться с клетками и инструктировать их выполнять новые запрограммированные функции. Наша способность перестраивать клеточную сигнализацию может обеспечить множество мощных приложений, таких как терапевтические клетки, запрограммированные на обнаружение селективного набора сигналов, связанных с заболеванием, и на локальный ответ точно настроенным образом.
Хотя эволюция достигла такого рода инноваций и точной инженерии клеточных функций, мы только начинаем понимать, как достичь такого рода цели. У нас есть хорошее фундаментальное понимание логики клеточных сигнальных механизмов и источников функциональной пластичности. Кроме того, были сделаны первые важные шаги в разработке новых рецепторно-сенсорных систем, а также новых или модифицированных схем обработки внутриклеточных сигналов. Несмотря на эти инструменты, на сегодняшний день было приложено очень мало усилий для того, чтобы связать эти типы компонентов новыми способами, чтобы получить более крупные интегральные схемы, способные давать очень точные и точные отклики.Такие усилия продолжаются. Например, Cell Propulsion Lab — это наномедицинский центр Национального института здравоохранения (http://nihroadmap.nih.gov/nanomedicine/devcenters/cellularcontrol.asp), который пытается использовать относительно простые противоопухолевые иммунные клетки, созданные с использованием синтетических рецепторов химерных антигенов ( CAR), и улучшают обработку их сигналов и набор ответов, которые они вызывают, чтобы оптимизировать клетки для экспансии ex vivo, , in vivo, выживания, противоопухолевой цитотоксичности и нарушения благоприятного микроокружения опухоли.Будет интересно увидеть, как будут развиваться эти типы усилий и как эти проблемы повысят сложность и надежность сотовой инженерии.
Новейшие инженерные датчики сигнализацииa | перенаправление собственных входов на новые выходы . С-концевой домен рецептора notch представляет собой фактор транскрипции, который высвобождается в результате трансмембранного протеолиза при активации лигандом дельта. Замена альтернативным доменом фактора транскрипции дает новый ответ экспрессии гена [26].Выход рецептора, сопряженного с G-белком (GPCR), может быть перенаправлен аналогичным образом путем слияния домена фактора транскрипции через привязку с сайтом протеазы TEV. Активация GPCR приводит к привлечению белка аррестина. Если в клетке экспрессируется слияние протеазы аррестин-TEV, активация GPCR приводит к высвобождению фактора транскрипции и новому выходу экспрессии гена [28]. Таким образом, активация GPCR может быть произвольно связана с новым транскрипционным выходом. Выход рецепторной тирозинкиназы (RTK) может быть перенаправлен за счет привлечения синтетических адаптеров домена Sh3 или PTB к активированному и фосфорилированному тирозин рецептору.Домен Sh3 может быть использован для рекрутирования протеазы TEV (чтобы снова высвободить искусственно связанный транскрипционный домен) [28] или для рекрутирования новых эффекторных доменов, таких как те, которые участвуют в гибели клеток [29].
b | инженерный новаторский контроль ввода для собственных ответов . GPCR были сконструированы так, чтобы их контролировали низкомолекулярные агонисты путем мутации их внеклеточной поверхности, так что они больше не связывают свои эндогенные лиганды (рецепторы, активируемые исключительно синтетическим лигандом — RASSL [32]).Рецепторы, которые активируют Т-клетки в ответ на произвольные входные данные, могут быть созданы путем слияния сконструированных одноцепочечных антител (scFv) с внутриклеточной областью Т-клеточного рецептора (дзета-цепь CD3), которые называются рецепторами химерных антигенов (CARs [16, 17]). Событие передачи сигнала, опосредованное рекрутингом, может быть помещено под световой контроль путем замены эндогенного взаимодействия на светозащитное взаимодействие, пара взаимодействий Phytochrome-PIF от растений [44].
Инженерно-пространственное регулированиеa | Цепь поляризации дикого типа контролирует образование одиночных почек. В почкующихся дрожжах локализованная активация полярности GTPase Cdc42 усиливается петлей положительной обратной связи — активный Cdc42 рекрутирует каркасный белок Bem1, совместно собирает активированную p21 киназу (PAK — Ste20) и Cdc42 GEF (Cdc24). Хотя клетка может иметь несколько фокусов Cdc42, они быстро распадаются на один доминантный фокус, который развивается только в клетки. Предполагается, что быстрая скорость обмена диффундирующим комплексом Bem1 / PAK / GEF между конкурирующими фокусами Cdc42 является критической для разделения в один доминантный фокус.
b | синтетическая цепь медленной поляризации приводит к образованию множественных бутонов . Чтобы проверить эту гипотезу, Bem1 был искусственно привязан к мембране через слитый мотив нацеливания на мембрану [65]. Хотя этот связанный с мембраной Bem1 может должным образом собирать комплекс Bem1 / PAK / GEF на участках активности Cdc42 (т.е. петле положительной обратной связи), обмен комплексом между конкурирующими фокусами Cdc42 происходит медленно (зависит от везикулярного транспорта через актиновые кабели и эндоцитоза) .Эта синтетическая поляризационная схема, следовательно, приводит к плохому разрешению конкурирующих фокусов Cdc42 и гораздо более высокой частоте (5% против ~ 0%) многопучковых клеток (микрофотографии из [65]).
Ссылки
2. Киль Ч., Юс Э., Серрано Л. Инженерные пути передачи сигналов. Клетка. 2010. 140 (1): 33–47. [PubMed] [Google Scholar] 3. Sprinzak D, Elowitz MB. Реконструкция генетических цепей. Природа. 2005; 438: 443–8. [PubMed] [Google Scholar] 4. Мукхерджи С., ван Ауденаарден А. Синтетическая биология: понимание биологического дизайна из синтетических цепей.Nat Rev Genet. 2009; 10: 859–71. [Бесплатная статья PMC] [PubMed] [Google Scholar] 5. Башор CJ, Хорвиц AA, Peisajovich SG, Lim WA. Перепрограммирование клеток: синтетическая биология как инструмент для исследования организационных принципов живых систем. Анну Рев Биофиз. 2010 16 февраля; [Epub перед печатью] [Бесплатная статья PMC] [PubMed] [Google Scholar] 6. Yeh BJ, Lim WA. Синтетическая биология: уроки истории синтетической органической химии. Nat Chem Biol. 2007; 3: 521–5. [PubMed] [Google Scholar] 7. Вайнберг Р. Биология рака.Наука о гирляндах; 2006. [Google Scholar] 9. Мюнтер С., Вэй М., Фришкнехт Ф. Сигнализация во время инфекции патогена. Sci STKE. 2006; 2006: re5. [PubMed] [Google Scholar] 10. Shan L, He P, Sheen J. Перехват сигнальных каскадов MAPK хозяина с помощью бактериальных эффекторов III типа. Клеточный микроб-хозяин. 2007; 1: 167–74. [PubMed] [Google Scholar] 11. Кискинис Э., Эгган К. Прогресс в клиническом применении плюрипотентных стволовых клеток для конкретных пациентов. J Clin Invest. 2010; 120: 51–9. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12.Линдвалл О., Кокая З. Стволовые клетки при нейродегенеративных расстройствах человека — время для клинического перевода? J Clin Invest. 2010; 120: 29–40. [Бесплатная статья PMC] [PubMed] [Google Scholar] 14. Варела-Рохена А., Карпенито С., Перес Э., Ричардсон М., Парри Р., Милон М., Шоллер Дж., Хао Х, Мексас А., Кэрролл Р. Г., Чемпион июня, Райли Дж. Л.. Генная инженерия Т-клеток для адоптивной иммунотерапии. Immunol Res. 2008; 42: 166–81. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Ли С.К., Чжоу Х., Хэм Т.С., Ли Т.С., Кизлинг Д.Д. Метаболическая инженерия микроорганизмов для производства биотоплива: от насекомых до синтетической биологии и топлива.Curr Opin Biotechnol. 2008; 19: 556–63. [PubMed] [Google Scholar] 16. Sadelain M, Brentjens R, Rivière I. Перспективы и потенциальные ловушки химерных антигенных рецепторов. Curr Opin Immunol. 2009; 21: 215–23. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Tlsty TD, Coussens LM. Строма опухоли и регуляция развития рака. Анну Рев Патол. 2006; 1: 119–50. [PubMed] [Google Scholar] 19. Поусон Т., Нэш П. Сборка клеточных регуляторных систем через домены взаимодействия белков. Наука. 2003; 300: 445–52.[PubMed] [Google Scholar] 20. Бхаттачарья Р.П., Ременьи А., Йе Б.Дж., Лим В.А. Домены, мотивы и каркасы: роль модульных взаимодействий в эволюции и подключении сигнальных цепей клетки. Анну Рев Биохим. 2006; 75: 655–80. [PubMed] [Google Scholar] 23. Кэрролл С.Б. Эво-дево и расширяющийся эволюционный синтез: генетическая теория морфологической эволюции. Клетка. 2008. 134: 25–36. [PubMed] [Google Scholar] 24. Скотт Дж. Д., Поусон Т. Передача сигналов в клетках в пространстве и времени: где белки объединяются, а когда разделяются.Наука. 2009; 326: 1220–4. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Пейсайович С., Гарбарино Дж., Вей П., Лим В.А. Быстрая диверсификация сигнальных фенотипов клеток за счет рекомбинации модульных доменов. Наука. в прессе. [Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Struhl G, Adachi A. Ядерный доступ и действие notch in vivo. Клетка. 1998. 93: 649–60. [PubMed] [Google Scholar] 27. Спринзак Д., Лакханпал А., ЛеБон Л., Сантат Л.А., Фонтес М.Э., Андерсон Г.А., Гарсия-Охалво Дж., Эловиц МБ. Цис-взаимодействия между Notch и Delta создают взаимоисключающие сигнальные состояния.Природа. в прессе. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Barnea G, Strapps W, Herrada G, Berman Y, Ong J, Kloss B, Axel R, Lee KJ. Генетический дизайн сигнальных каскадов для регистрации активации рецепторов. Proc Natl Acad Sci USA. 2008; 105: 64–9. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Howard PL, Chia MC, Del Rizzo S, Liu FF, Pawson T. Перенаправление передачи сигналов тирозинкиназы на путь апоптоза каспазы через химерные адаптерные белки. Proc Natl Acad Sci U S. A. 2003; 100: 11267–72.[Бесплатная статья PMC] [PubMed] [Google Scholar] 30. Conklin BR, Hsiao EC, Claeysen S, Dumuis A, Srinivasan S, Forsayeth JR, Guettier JM, Chang WC, Pei Y, McCarthy KD, Nissenson RA, Wess J, Bockaert J, Roth BL. Разработка сигнальных путей GPCR с помощью RASSL. Нат методы. 2008; 5: 673–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31. Армбрустер Б.Н., Ли Х, Пауш М.Х., Херлитце С., Рот Б.Л. Доработка замка для соответствия ключу для создания семейства рецепторов, связанных с G-белком, активно активируемых инертным лигандом.Proc Natl Acad Sci U S. A. 2007; 104: 5163–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 32. Трус П., Вада Х.Г., Фальк М.С., Чан С.Д., Мэн Ф., Акил Х., Конклин Б.Р. Управление передачей сигналов с помощью специально разработанного Gi-связанного рецептора. Proc Natl Acad Sci U S. A. 1998; 95: 352–7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 33. Zhao GQ, Zhang Y, Hoon MA, Chandrashekar J, Erlenbach I., Ryba NJ, Zuker CS. Рецепторы сладкого вкуса и вкуса умами млекопитающих. Клетка. 2003. 115: 255–66. [PubMed] [Google Scholar] 34. Redfern CH, Coward P, Дегтярев М.Ю., Lee EK, Kwa AT, Hennighausen L, Bujard H, Fishman GI, Conklin BR.Условная экспрессия и передача сигналов специально сконструированного Gi-сопряженного рецептора у трансгенных мышей. Nat Biotechnol. 1999; 17: 165–9. [PubMed] [Google Scholar] 35. Корсон Т.В., Аберли Н., Экипаж СМ. Дизайн и применение бифункциональных малых молекул: почему две головы лучше, чем одна. ACS Chem Biol. 2008; 3: 677–692. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Поллок Р., Клэксон Т. Экспрессия гена, регулируемая димеризером. Curr Opin Biotechnol. 2002; 13: 459–67. [PubMed] [Google Scholar] 37. Ирвинг Б.А., Вайс А.Цитоплазматического домена дзета-цепи Т-клеточного рецептора достаточно для соединения с рецептор-ассоциированными путями передачи сигнала. Клетка. 1991; 64: 891–901. [PubMed] [Google Scholar] 38. Гросс Г., Горохов Г., Вакс Т., Эшхар З. Создание эффекторных Т-клеток, экспрессирующих химерный Т-клеточный рецептор со специфичностью типа антитела. Transplant Proc. 1989; 21: 127–30. [PubMed] [Google Scholar] 39. Eshhar Z, Waks T, Bendavid A, Schindler DG. Функциональная экспрессия генов химерных рецепторов в Т-клетках человека. J Immunol Methods.2001; 248: 67–76. [PubMed] [Google Scholar] 40. Maher J, Brentjens RJ, Gunset G, Rivière I, Sadelain M. Цитотоксичность и пролиферация Т-лимфоцитов человека, управляемые одним химерным рецептором TCRzeta / CD28. Nat Biotechnol. 2002; 20: 70–5. [PubMed] [Google Scholar] 41. Карпенито К., Милоне М.К., Хассан Р., Симонет Дж. К., Лакхал М., Сухоски М. М., Варела-Рохена А., Хейнс К. М., Хейтджан Д. Ф., Альбельда С. М., Кэрролл Р. Г., Райли Дж. Л., Пастан I, Джун Чемпион. Контроль крупных установленных ксенотрансплантатов опухолей с генетически перенаправленными человеческими Т-клетками, содержащими домены CD28 и CD137.Proc Natl Acad Sci U S. A. 2009; 106: 3360–5. [Бесплатная статья PMC] [PubMed] [Google Scholar] 42. Чжан Ф., Араванис А.М., Адамантидис А., де Лесеа Л., Дейссерот К. Автоматические выключатели: оптические технологии для исследования нейронных сигналов и систем. Nat Rev Neurosci. 2007; 8: 577–81. [PubMed] [Google Scholar] 43. Airan RD, Thompson KR, Fenno LE, Bernstein H, Deisseroth K. Временный контроль внутриклеточной передачи сигналов in vivo. Природа. 2009; 458: 1025–9. [PubMed] [Google Scholar] 44. Левская А, Вайнер О.Д., Лим В.А., Фойгт CA.Пространственно-временной контроль клеточной передачи сигналов с использованием переключаемого светом белкового взаимодействия. Природа. 2009; 461: 997–1001. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Wu YI, Frey D, Lungu OI, Jaehrig A, Schlichting I., Kuhlman B, Hahn KM. Генетически кодируемый фотоактивируемый Rac контролирует подвижность живых клеток. Природа. 2009; 461: 104–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 46. Lim WA. Модульная логика сигнальных белков: построение аллостерических переключателей из простых связывающих доменов. Curr Opin Struct Biol.2002; 12: 61–8. [PubMed] [Google Scholar] 47. Prehoda KE, Scott JA, Mullins RD, Lim WA. Интеграция нескольких сигналов посредством совместной регуляции комплекса N-WASP-Arp2 / 3. Наука. 2000; 290: 801–6. [PubMed] [Google Scholar] 48. Ю Б., Мартинс И.Р., Ли П., Амарасинге Г.К., Уметани Дж., Фернандес-Запико М.Э., Билладо Д.Д., Мачиус М., Томчик Д.Р., Розен М.К. Структурные и энергетические механизмы кооперативного аутоингибирования и активации Vav1. Клетка. 2010. 140: 246–56. [Бесплатная статья PMC] [PubMed] [Google Scholar] 49.Dueber JE, Yeh BJ, Chak K, Lim WA. Перепрограммирование управления переключателем аллостерической сигнализации посредством модульной рекомбинации. Наука. 2003; 301: 1904–8. [PubMed] [Google Scholar] 50. Йе Би Джей, Рутильяно Р. Дж., Деб А., Бар-Саги Д., Лим ВА. Перестройка путей клеточной морфологии с помощью факторов обмена синтетических гуаниновых нуклеотидов. Природа. 2007. 447: 596–600. [PubMed] [Google Scholar] 51. Дуэбер Дж. Э., Мирский Е. А., Лим В. А.. Разработка синтетических сигнальных белков со сверхчувствительным управлением вводом / выводом. Nat Biotechnol.2007; 25: 660–2. [PubMed] [Google Scholar] 52. Ядав С.С., Йе Б.Дж., Крэддок Б.П., Лим В.А., Миллер В.Т. Реинжиниринг сигнальных свойств киназы семейства Src. Биохимия. 2009. 48: 10956–62. [Бесплатная статья PMC] [PubMed] [Google Scholar] 53. Гаррингтон Т.П., Джонсон Г.Л. Организация и регуляция сигнальных путей митоген-активируемой протеинкиназы. Curr Opin Cell Biol. 1999; 11: 211–8. [PubMed] [Google Scholar] 54. Шварц М.А., Мадхани HD. Принципы специфичности передачи сигналов MAP-киназы у Saccharomyces cerevisiae.Анну Рев Жене. 2004. 38: 725–48. [PubMed] [Google Scholar] 55. Чой К.Ю., Саттерберг Б., Лион DM, Элион Э.А. Ste5 связывает несколько протеинкиназ в каскаде MAP-киназ, необходимых для спаривания у S. cerevisiae. Клетка. 1994. 78 (3): 499–512. [PubMed] [Google Scholar] 56. Printen JA, Sprague GF., Jr. Белковые взаимодействия в пути ответа феромонов дрожжей: Ste5p взаимодействует со всеми членами каскада киназ MAP. Генетика. 1994. 138 (3): 609–19. [Бесплатная статья PMC] [PubMed] [Google Scholar] 57. Посас Ф, Сайто Х.Осмотическая активация пути HOG MAPK через Ste11p MAPKKK: роль каркаса Pbs2p MAPKK. Наука. 1997. 276 (5319): 1702–5. [PubMed] [Google Scholar] 58. Park SH, Zarrinpar A, Lim WA. Перестройка путей MAP-киназы с использованием альтернативных механизмов сборки каркаса. Наука. 2003; 299: 1061–4. [PubMed] [Google Scholar] 59. Харрис К., Ламсон Р.Е., Нельсон Б., Хьюз Т.Р., Мартон М.Дж., Робертс С.Дж., Бун С., Прайчак П.М. Роль каркасов в специфичности пути киназы MAP, выявленная путем индивидуального дизайна сигнальных белков, предназначенных для этого пути.Curr Biol. 2001. 11 (23): 1815–24. [PubMed] [Google Scholar] 60. Dodge-Kafka KL, Soughayer J, Pare GC, Carlisle Michel JJ, Langeberg LK, Kapiloff MS, Scott JD. Заякоренный белок mAKAP протеинкиназы А координирует два интегрированных эффекторных пути цАМФ. Природа. 2005. 437 (7058): 574–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 61. Мишра П., Соколич М., Уолл М.А., Грейвс Дж., Ван З., Ранганатан Р. Динамическое формирование каркаса в системе передачи сигналов, связанной с G-белком. Клетка. 2007. 131 (1): 80–92. [PubMed] [Google Scholar] 62.Башор CJ, Helman NC, Yan S, Lim WA. Использование инженерных взаимодействий каркаса для изменения динамики передачи сигналов пути киназы MAP. Наука. 2008. 319 (5869): 1539–43. [PubMed] [Google Scholar] 63. Чант Дж. Полярность клеток в дрожжах. Annu Rev Cell Dev Biol. 1999; 15: 365–91. [PubMed] [Google Scholar] 64. Козубовски Л., Сайто К., Джонсон Дж. М., Хауэлл А. С., Зила Т. Р., Лью Д. Д.. Поляризация, нарушающая симметрию, управляемая комплексом Cdc42p GEF-PAK. Curr Biol. 2008. 18 (22): 1719–26. [Бесплатная статья PMC] [PubMed] [Google Scholar] 65. Howell AS, Savage NS, Johnson SA, Bose I, Wagner AW, Zyla TR, Nijhout HF, Reed MC, Goryachev AB, Lew DJ.Необычность в поляризации: перестройка дрожжевых клеток для образования двух бутонов. Клетка. 2009. 139 (4): 731–43. [Бесплатная статья PMC] [PubMed] [Google Scholar] 66. Зарринпар А, Парк SH, Лим WA. Оптимизация специфичности в сети взаимодействия белков клетки путем отрицательного отбора. Природа. 2003. 426 (6967): 676–80. [PubMed] [Google Scholar] 67. Stiffler MA, Chen JR, Grantcharova VP, Lei Y, Fuchs D, Allen JE, Zaslavskaia LA, MacBeath G. Селективность связывания домена PDZ оптимизирована по протеому мыши. Наука. 2007. 317 (5836): 364–9.[Бесплатная статья PMC] [PubMed] [Google Scholar] 68. Эрнст А., Сазинский С.Л., Хуэй С., Каррелл Б., Дхарси М., Сешагири С., Бадер Г.Д., Сидху С.С. Быстрая эволюция функциональной сложности в семействе доменов. Sci Signal. 2009; 2 (87): ра50. [PubMed] [Google Scholar] 69. Григорян Г., Рейнке А.В., Китинг А.Е. Дизайн специфичности взаимодействия с белками дает селективные bZIP-связывающие пептиды. Природа. 2009. 458 (7240): 859–64. [Бесплатная статья PMC] [PubMed] [Google Scholar] 70. Хуанг Дж., Коиде А., Макабе К., Коиде С. Дизайн скачков функции белка путем направленной эволюции интерфейса домена.Proc Natl Acad Sci U S. A. 2008; 105 (18): 6578–83. [Бесплатная статья PMC] [PubMed] [Google Scholar] 71. Зауэр Б. Индуцируемое нацеливание гена у мышей с использованием системы Cre / lox. Методы. 1998. 14 (4): 381–92. [PubMed] [Google Scholar]Разработка индивидуальных сигнальных цепей клеток
Nat Rev Mol Cell Biol. Авторская рукопись; доступно в PMC 2010 8 ноября.
Опубликован в окончательной отредактированной форме как:
PMCID: PMC2975372
NIHMSID: NIHMS246517
Wendell A.Lim
HHMI и отдел клеточной и молекулярной фармакологии, UCSF, The Cell Propulsion Lab, NIH Nanomedicine Development Center, NSF Synthetic Biology Engineering Research Center
Венделл А. Лим, HHMI и отдел клеточной и молекулярной фармакологии, UCSF , Лаборатория движения клеток, Центр разработки наномедицины NIH, Исследовательский центр синтетической биологии NSF;
См. Другие статьи в PMC, в которых цитируется опубликованная статья.Abstract
Живые клетки развили широкий спектр сложных сигнальных реакций, которые позволяют им выживать в различных условиях окружающей среды и выполнять определенные физиологические функции.Наше все более сложное понимание молекулярных механизмов клеточных сигнальных сетей у эукариот выявило удивительно модульную организацию, и синтетические биологи изучают, как это можно использовать для создания клеток с новым сигнальным поведением. Этот подход начинает раскрывать логику того, как клетки могут развивать инновационные новые функции, и подталкивает нас к захватывающей возможности создания пользовательских клеток с точными функциями восприятия и реакции, которые могут быть полезны в медицине и биотехнологии.
Ключевые слова: передача сигналов клеток, инженерия, синтетическая биология, терапевтический, MAP-киназа, каркас, модули, белковые взаимодействия, N-WASP, рецепторы, GPCR, Notch, RTK, рак, адоптивная иммунотерапия, химерные антигенные рецепторы, Т-клетки. , оптический контроль, биопродукция
Живые клетки — это высокодинамичные системы, которые используют сложные молекулярные сигнальные цепи для мониторинга внешнего и внутреннего состояния и выполнения соответствующих физиологических реакций. Как и любая сенсорная машина, созданная или созданная человеком, эти клеточные сигнальные цепи содержат подсистемы принятия решений, которые действуют как сенсоры и процессоры (например, рецепторы и их последующие эффекторы), которые в конечном итоге контролируют различные подсистемы ответа (такие как транскрипция генов и динамика цитоскелета) ( ).Основная цель современной клеточной биологии — понять, как эти молекулярные сигнальные системы достигают своих сложных ответов, которые оптимально настроены для их физиологической роли. Хотя подавляющее большинство исследований нацелено на анализ, картирование и анализ сигнальных сетей клеток, наше растущее понимание того, как работают эти системы, привело к появлению радикально нового подхода — усилий по разработке и созданию собственных синтетических сигнальных цепей [1,2 ].
Общая организация и поведение сигнальных цепей ячеекa | Клетки обычно воспринимают стимулы окружающей среды через рецепторы и другие датчики .Затем эта информация обрабатывается внутриклеточными сигнальными сетями, которые, в свою очередь, задействуют различные клеточные продукты, включая экспрессию генов, секрецию, изменения цитоскелета и рост клеток.
b | Некоторые из основных проблем в развитии или разработке новых сигнальных цепей: : достижение правильной связи определенных входов и конкретных выходов; настройка количественного поведения сигнального ответа — доза-реакция и динамика — так, чтобы они были оптимальными для физиологической функции; и создание устойчивых пространственно самоорганизующихся процессов, таких как процессы, связанные с поляризацией клеток, направленной подвижностью, делением клеток и компартментализацией клеток.
Здесь мы сосредоточимся на синтетической биологии передачи сигналов и посмотрим, как можно спроектировать сигнальные схемы эукариотических клеток для создания клеток с заданным поведением передачи сигналов. Эукариотические клетки используют сети сигнальных белков, чтобы ощущать окружающую их среду и обеспечивать быстрые ответы. Поскольку сети обработки сигналов в клетках функционируют в трехмерном пространстве, они также контролируют сложные пространственные или морфологические клеточные реакции. Мы рассмотрим, как могут быть созданы сигнальные цепи с точным поведением реакции, учитывая, как определяется специфичность ответа (то есть, какие наборы выходных сигналов связаны с конкретным входом), как точно настроенная доза-реакция или временная динамика профили ответов оптимизированы для конкретных физиологических функций и того, как можно достичь сложного пространственного и морфологического контроля ().Мы также рассмотрим, почему появились усилия по разработке и созданию специализированных синтетических сигнальных цепей, как они могут обеспечить более глубокое видение принципов и механизмов разработки молекулярных сигнальных систем и как индивидуализированные реакции на поведение могут быть применены в медицине и биотехнологии. Наконец, мы рассматриваем, как в будущем могут быть разработаны инструменты и методы, которые упростят разработку клеточного поведения.
Почему инженерная сигнализация ячейки?
Прежде чем рассматривать конкретные примеры сконструированных сигнальных путей, полезно обсудить мотивацию инженерии клеточной сигнализации.Попытка создать новое сигнальное поведение в клетках может показаться смелой и глупой целью, учитывая, что у нас еще нет полного или надежного предсказательного понимания естественных сигнальных цепей клеток. Однако разработка клеточной сигнализации — это не просто процесс применения уже хорошо разработанного понимания, но она предлагает подход к «пониманию через построение». В то время как биология традиционно была наукой анализа и деконструкции для выявления генов и молекул, которые важны для конкретного процесса, синтетическая биология предлагает обратный подход, фокусируясь на том, как отдельные молекулярные части могут быть собраны в системы, которые выполняют сложное поведение.Поскольку в настоящее время у нас есть полностью секвенированные геномы и огромное количество протеомных данных, нам не хватает не полного списка молекулярных частей, а скорее понимания того, как эти части сочетаются друг с другом функционально согласованным образом. Разработка новых сигнальных сетей клеток предлагает нам подход к тестированию и расширению нашего понимания принципов организации сложных молекулярных систем.
В этом смысле синтетическая биология передачи сигналов не просто ориентирована на достижение цели приложения, такой как построение клетки с целевой функцией, но также является исследовательской наукой, в которой важно понимать, какие конструкции «работают». и как они соотносятся с «неработающими» дизайнами.Если, например, у кого-то есть естественная сигнальная сеть, которая выполняет сложное представляющее интерес поведение, традиционная генетическая деконструкция может использоваться для идентификации молекул и связей, которые необходимы и важны для функции (). Однако затем можно использовать синтетические подходы для систематического изучения многих типов изменений — альтернативных сетевых связей, настройки силы связей, добавления новых связей — для проверки того, какие сети совместимы с этим интересующим поведением. Анализируя естественную сеть или проектируя единственную успешную схему, вряд ли можно получить более глубокое понимание функционального ландшафта, которое может дать более полное и систематическое исследование синтетической схемы () [3–5].В этом смысле попытки спроектировать клеточное поведение сродни ранней истории синтетической органической химии, где синтез новых или модифицированных молекул обеспечил дополнительный подход к химическому анализу в развитии фундаментальных теорий химической связи, структуры и реакционной способности [ 6]
Зачем менять схемы сигнальных цепей ячеек?и | понимание принципов дизайна. Традиционно для анализа сигнальной сети используются такие методы, как нарушение гена.Синтетические подходы предлагают дополнительную информацию, создавая альтернативные версии сети, которые различаются как подключением к сети, так и мощностью каналов. Сопоставляя пространство функциональных (красные кружки) и нефункциональных (синие кружки) вариантов, можно получить более глубокое понимание функциональных требований.
b | конструирует дизайнерские сигнальные пути для терапевтических или биотехнологических приложений. Мы надеемся собрать набор сигнальных модулей, которые можно использовать для создания ячеек со спроектированными сигнальными ответами.Противораковая клетка может обнаруживать комбинацию сигналов опухоли и давать такие ответы, как выработка реагентов для визуализации, уничтожение клеток или секреция факторов, нарушающих микросреду опухоли. Такая ячейка может также иметь предохранительные выключатели, которые могли бы отключить ячейку при необходимости. Иммуносупрессивная клетка может обнаруживать комбинацию аутоиммунного ответа или сигналов отторжения трансплантата и запускать локальные контрмеры, такие как секреция противовоспалительных цитокинов. Интеллектуальная биопродуктивная (ферментационная) клетка будет спроектирована так, чтобы точно модулировать поток роста по сравнению с производственными путями в ответ на стрессовое состояние клетки, тем самым оптимизируя общий урожай.
Изучение пластичности сигнальных путей и того, как их функции могут быть настроены, также имеет отношение к патологии и лечению заболеваний. Многие виды рака обладают онкогенными мутациями, которые эффективно «переплетают» сигнальные сети клеток, контролирующие баланс между ростом, дифференцировкой и гибелью клеток [7]. Точно так же многие внутриклеточные патогены, включая бактерии и вирусы, производят специфические белки, которые «переплетают» эндогенные сигнальные пути [7]. 8–10]. Многие белки бактериальных патогенов, которые взаимодействуют с клеточной сигнальной киназой и путями регуляции актина, часто для подавления иммунного ответа хозяина или усиления инфекции (см. Дополнительную вставку 1).Таким образом, используя синтетическую биологию для понимания пластичности путей и того, как их поведение изменяется из-за сетевых возмущений, мы можем получить лучшую основу для понимания стратегий, которые патоген принимает для использования внутренней уязвимости сигнальных сетей. Более того, мы можем разработать стратегии для возврата больной сети к стабильному, непатологическому поведению. Наиболее стабильные методы лечения на основе сети могут включать не просто блокировку первичного онкогенного белка лекарством, а изменение структуры сети таким образом, чтобы она располагалась в новой и стабильной области поведенческого пространства.
Применение инженерной передачи сигналов в терапии и биотехнологии
Еще одним мотивом для разработки сигнального поведения клеток является возможность конструирования клеток, запрограммированных для выполнения точно разработанных приложений (). Представьте себе, если бы мы могли имитировать и превзойти эволюцию, используя набор молекулярных компонентов для генетической инженерии клеток, которые выполняют индивидуально разработанные реакции. По мере развития биологии стволовых клеток [11–12] и развития таких методов, как адоптивная иммунотерапия [13–14], возможность использования клеточной терапии становится все ближе, но это потребует сложной клеточной инженерии для точного контроля поведения клеток.Например, без нового контроля, как может быть направлена правильная миграция и дифференцировка стволовых клеток для регенеративной медицины при отсутствии нормальных сигналов развития? Более того, по мере того, как все больше промышленных производственных процессов задействуют биологические организмы (такие как производство биотоплива или материалов) [15], может появиться возможность разработать более разумные производственные штаммы, которые, как и макроскопические производственные объекты, будут иметь системы клеточного контроля, которые отслеживают внешние и внутренние состояния для оптимизации производство.Это может быть особенно важно, поскольку мы просим ферментирующие организмы, такие как дрожжи, производить широкий спектр материалов, которые могут оказывать токсическое действие.
Разработанные противораковые клетки
Если мы сосредоточимся на разработке индивидуальных терапевтических клеток, которые могут воспринимать сигналы болезни и выполнять целенаправленные и точно откалиброванные терапевтические программы, какое поведение мы хотели бы? Иммунные клетки, такие как Т-лимфоциты или естественные клетки-киллеры, можно модифицировать для идентификации и уничтожения опухолевых клеток.Такие клетки уже можно удалить у пациентов, генетически модифицировать, размножить ex vivo и адаптивно перенести обратно пациенту [16-17]. Противораковая клетка может быть разработана для обнаружения комбинации сигналов, связанных с опухолью, включая специфические опухолевые антигены, гипоксию, органоспецифические антигены, а также специфические факторы роста и цитокины, которые секретируются опухолями, чтобы избежать нормальных иммунных ответов и создать микроокружение, способствующее развитию опухолей [18],. Инженерные клетки, которые распознают эти факторы, но связаны с противоопухолевым ответом, были бы идеальными.Также критически важно разработать внешний контроль (например, небольшую молекулу) или предохранительные переключатели для этих терапевтических клеток, чтобы их поведение можно было отключить или ослабить в ответ на нежелательные побочные эффекты, или чтобы титровать величину их реакции.
Сконструированные клетки, которые обнаруживают эти специфические для опухоли входные данные, могут быть сконструированы для получения ряда различных ответов, таких как производство агентов визуализации, которые помогают в идентификации опухолей и метастазов, и контроль эндогенных иммунных клеточных реакций, таких как хемотаксис, фагоцитоз и убийство клеток.Возможно, наиболее важно то, что эти терапевтические клетки могут быть запрограммированы на секретирование факторов, нарушающих локальное микроокружение опухоли, таких как провоспалительные цитокины и факторы антиангиогенеза, что делает их непригодными для устойчивого роста опухоли. Это было бы эквивалентно созданию специальной иммунной клетки, которая выводит из строя опухолевые клетки и микроокружение на нескольких уровнях.
Направленная иммуносупрессия
Иммунная клетка также может быть разработана для блокирования аутоиммунного заболевания или отторжения трансплантированных органов.Обычная иммуносупрессивная лекарственная терапия имеет широкие и серьезные системные эффекты. Сконструированная клетка может быть запрограммирована на местную иммуносупрессивную реакцию, возможно, в ответ на специфические аутоиммунные антигены или антигены трансплантата в сочетании с цитокиновыми сигнатурами сильного аутоиммунного ответа. Такие клетки могут быть запрограммированы на хемотаксис к участкам этих сигналов и реагировать путем секреции противовоспалительных цитокинов, которые отключили бы воспалительные петли положительной обратной связи, которые обычно приводили бы к полномасштабной аутоиммунной реакции или реакции отторжения.
Хотя индивидуально разработанные терапевтические клетки — это будущее, полезно подумать о том, какое поведение обнаружения и реакции будет ценным, так как они обеспечивают полезные целевые вехи в разработке инструментов и стратегий для перестройки клеток.
Можно ли проектировать сети передачи сигналов сотовой связи?
Существуют большие разногласия относительно того, действительно ли элементы можно спроектировать. Системы клеточной сигнализации настолько тонко оптимизированы, что наше вмешательство приведет к катастрофическим сбоям, или настолько надежно спроектированы эволюцией, что добавление новых генов и сетевых связей не сможет существенно изменить функцию? Очевидно, что эволюция смогла перестроить клеточные сигнальные пути, чтобы получить разнообразные ответы — на определенном уровне они относительно пластичны и эволюционируют.Таким образом, прежде чем пытаться создать новое клеточное поведение, может быть поучительно подумать о том, как эволюция может достичь инновационных новых функций.
Отличительной чертой сигнальных белков, которая, как полагают, играет важную роль в эволюции, является их модульная структура. Они почти всегда состоят из множества модульных доменов, некоторые из которых выполняют каталитическую функцию, а многие — специфические регуляторные функции или функции взаимодействия [19, 20]. Эти модульные домены встречаются в различных сигнальных белках в самых разных комбинациях.Это привело к модели, согласно которой разнообразие сигнальных функций может развиваться посредством рекомбинации этого набора доменов. Таким образом, в принципе, если бы мы могли понять, как эволюция работает с этими модулями, мы могли бы использовать тот же набор инструментов, чтобы найти области пространства поведения, которые эволюция, насколько нам известно, еще не исследовала.
Почему сигнальные белки и системы настолько модульны? Большинство согласны с тем, что в эволюционной временной шкале организмы находятся под давлением приспособленности к развитию инновационных клеточных сигнальных реакций, которые могут привести к преимуществам в изменяющейся окружающей среде и по сравнению с конкурирующими организмами.Под воздействием такого рода изменяющегося давления приспособленности модульные системы могут спонтанно развиваться как способ облегчить более быструю диверсификацию функций [21]. Алон и его сотрудники смоделировали эволюцию биологической сети, используя эволюционные алгоритмы для поиска простых вычислительных сетей, которые решают поставленную цель [22]. Когда они неоднократно меняют целевую цель, результирующие сети спонтанно развивают более модульные решения — сети, которые имеют внутри себя функциональные подсети. Эти заранее сформированные подсети — модули — могут быть быстро переподключены новыми способами для перехода от одной целевой функции к другой.По сути, кажется, что модули предоставляют способ быстро перемещаться из одного функционального пространства в другое, перепрыгивая через обширные области нефункционального сетевого пространства. Таким образом, модульная организация сигнальных белков и сетей может отражать давление на эти системы с целью создания поведения, которое соответствует потребностям постоянно меняющейся среды.
Важность модульности в облегчении эволюции новых функций согласуется с концепциями эволюции и развития, в которых утверждается, что большая часть диверсификации функций и морфологии организмов эволюционирует через альтернативное регулирование существующих компонентов, а не на изобретение принципиально новых компонентов [23].Хотя многие из этих идей были разработаны с упором в первую очередь на регуляцию генов с помощью различных цис-действующих модулей, они также могут применяться к регуляции ключевых каталитических сигнальных модулей с помощью разнообразных локализационных и регуляторных модулей [24,25]. Неудивительно, что многие из усилий по разработке нового сигнального поведения, описанного ниже, используют стратегии рекомбинации модульных функциональных единиц новыми способами, таким образом, по сути, используя эволюционную стратегию для создания новой функции.
Разработка новых сенсорных систем
Одним из наиболее важных инструментов для изменения поведения клеток будет способность создавать новые датчики и рецепторы для целевых входов.Однако это, пожалуй, наименее охарактеризованный элемент в инженерии клеточной сигнализации, потому что вселенная возможных входов настолько обширна и часто включает проблему работы с относительно сложными мембранно-ассоциированными мембранными белками. Ниже мы описываем недавний прогресс в модификации или конструировании различных рецепторных молекул.
Перенаправление выхода естественных рецепторов
Природные рецепторы, которые обнаруживают специфические эндогенные входы, могут быть спроектированы для генерации неродной выходной реакции.Есть несколько примеров перенаправления нативного рецептора, чтобы вызвать новый транскрипционный ответ. Один из таких подходов использует модульную структуру рецепторного белка Notch. Notch — это трансмембранный рецептор, который обнаруживает белок Delta, присутствующий на соседних клетках, — критический канал межклеточной коммуникации в развитии и дифференцировке. Когда Delta связывает Notch, трансмембранная область Notch расщепляется мембранной протеазой, высвобождая C-концевой домен Notch в цитоплазму.Этот домен может проникать в ядро и активировать транскрипцию гена. Struhl et al. Показали, что этот модуль фактора транскрипции рецептора notch может быть заменен синтетическим фактором транскрипции (Gal4-AD), так что при активации in vivo этот химерный рецептор notch может активировать гены, нацеленные на новый фактор транскрипции [26 , 27]. Хотя эту конструкцию использовали в качестве репортера для активации Notch, ее можно было легко использовать для связывания обнаружения нативного дельта-лиганда с совершенно новым набором ненативных генов-мишеней.
Barnea et al. Расширили эту модульную стратегию, вдохновленную Notch, путем создания новых транскрипционных выходов для других рецепторов, которые обычно не используют этот тип механизма активации протеаз [28]. Когда рецепторы, сопряженные с G-белком (GPCR), активируются своими специфическими лигандами, они часто рекрутируют β-аррестин, который участвует в подавлении передачи сигналов GPCR. Barnea et al. Слили аррестин с высокоспецифичной протеазой вируса травления табака (TEV), так что он был совместно задействован в активированных GPCR.Синтетический фактор транскрипции также был слит с цитоплазматическим хвостом GPCR, связанным сайтом расщепления TEV. Таким образом, когда сконструированный слитый белок GPCR активируется своим эндогенным лигандом, он рекрутирует партнера протеазы аррестин-TEV, который расщепляет и высвобождает домен фактора транскрипции из GPCR, посредством чего он может проникать в нуклеазу и активировать гены-мишени. Эта система успешно использовалась для связывания новых репортеров транскрипции с активацией широкого спектра специфических GPCR.Ответ очень специфичен благодаря специфичности расщепления TEV. В принципе, эту стратегию можно использовать для связывания любого эндогенного сигнала, опосредованного GPCR, с экспрессией желаемых генов-мишеней.
Barnea et al. Также использовали эту стратегию для связывания передачи сигналов эндогенной рецепторной тирозинкиназы (RTK) с новыми выходами транскрипции [28]. Большинство RTK при стимуляции активируют свои киназные домены, которые опосредуют аутофосфорилирование цитоплазматических тирозинов для рекрутирования белков, содержащих домен Sh3.Здесь протеаза TEV была слита с рекрутированными доменами Sh3, а синтетический фактор транскрипции был слит с цитоплазматическим хвостом RTK через сайт расщепления протеазой TEV. Итак, активация RTK ведет к рекрутированию слияния Sh3-домен-TEV, высвобождению ассоциированного с рецептором фактора транскрипции и транскрипции гена инженерии. Примечательно, что эта простая модульная стратегия может быть применена к нескольким классам рецепторов, если они привлекают определенный белок-партнер при активации.
Howard et al. Использовали модульность передачи сигналов RTK для перенаправления сигнала онкогенного роста на апоптотический ответ [29]. Они сконструировали новый адаптерный белок Sh3, в котором домен Sh3, распознающий активированный RTK, был слит с доменом эффектора смерти от Fadd. Таким образом, активация RTK привела к рекрутированию в мембрану домена смерти, что вызвало ответ клеточной смерти. Возможность увязки других новых результатов с этими ключевыми событиями найма еще недостаточно изучена.
Рецепторы, которые обнаруживают новые входные данные малых молекул
Вышеупомянутые стратегии сосредоточены на способах получения рецепторов, которые обнаруживают эндогенные сигнальные молекулы, и конструируют их так, чтобы вызывать новые ответы. Однако во многих случаях для клеточной инженерии могут потребоваться рецепторы, которые обнаруживают новые сигналы, для которых нет эндогенных рецепторов. Эти новые сигналы включают в себя небольшие молекулы, которые мы можем захотеть обеспечить внешнее управление инженерной системой.
Относительно хорошие успехи были достигнуты в использовании GPCR в качестве платформы для конструирования контролируемых рецепторов на малых молекулах.Некоторые GPCR, такие как опиоидные рецепторы, могут активироваться их эндогенными лигандами и специфическими низкомолекулярными агонистами. Конклин, Рот и его сотрудники сконструировали молекулы, известные как рецепторы, активируемые исключительно синтетическими лигандами (RASSL) [30,32]. Эти рецепторы мутированы так, что они не могут связывать свой эндогенный лиганд, но активируются и вызывают свой эндогенный нисходящий эффект в ответ на небольшой фармакологически инертный молекулярный агонист.
GPCR различаются по своим выходам, отчасти потому, что отдельные рецепторы связываются со специфическими гетеротримерными G-белками.Дальнейшая разработка дала версии RASSL, которые специфически связаны с каждым из этих отдельных нисходящих путей, тем самым позволяя малым молекулам контролировать очень разнообразный набор выходов. Эти RASSL были успешно применены у трансгенных мышей — по сути, перестраивая передачу сигналов в полноценном живом организме — в основном в качестве диагностического и аналитического инструмента. Применение было разнообразным, учитывая широкое использование GPCR в разных тканях. Например, мыши, несущие вкусовые нейроны, экспрессирующие RASSL, проявляли специфические сладкие (привлекательные) или горькие (аверсивные) ответы на воду, смешанную с агонистом (спирадолином), в зависимости от того, в каком типе нейрона они экспрессировались [33].Кроме того, экспрессия RASSL в клетках сердца позволяет контролировать частоту сердечных сокращений путем введения спирадолина [34]. То, что эти рецепторы in vivo так надежно работают, , намекает на их потенциальную полезность в более сложной клеточной инженерии.
Химические димеризаторы образуют другую стратегию достижения контроля малых молекул над передачей сигналов. Такие стратегии были рассмотрены в другом месте [35,36] и не будут здесь обсуждаться.
Рецепторы, которые обнаруживают определенные пользователем антигены
Было бы идеально разработать рецепторы, которые могут воспринимать ассоциированные с заболеванием антигены, такие как белок, сильно экспрессирующийся в опухоли или инфекционном агенте.Если бы рецепторы могли быть сконструированы для достижения такого же разнообразия и избирательности распознавания, что и антитела, можно было бы обнаруживать широкий спектр входных сигналов и связывать их с конкретными ответами. Химерные антигенные рецепторы (CAR) — рецепторы, созданные с использованием одноцепочечных антител (scFv) как часть механизма их обнаружения, — были разработаны как универсальный каркас этого типа. Эта стратегия проистекает из модульности рецепторов иммунных клеток, таких как рецептор Т-клеток. Хотя Т-клеточный рецептор представляет собой сложный мультибелковый комплекс, сшивания цитоплазматической области субъединицы дзета-цепи CD3 достаточно для индукции передачи сигналов Т-клетками [37].Дзета-цепь CD3 содержит мотивы, которые фосфорилируются при активации тирозинкиназами, такими как Lck, для индукции рекрутирования белков, содержащих домен Sh3, таких как киназа ZAP-70. Слияние цитоплазматической области дзета-цепи CD3 с внеклеточным одноцепочечным антителом (scFv) дает рецептор, часто называемый «Т-тельцем», который при экспрессии в Т-клетках приводит к целенаправленному уничтожению клеток, экспрессирующих узнаваемый антиген (предположительно, поверхностные антигены сшивают и активируют химерные рецепторы) [38,39].Слияние scFv с внутриклеточной областью рецептора Fc (гамма-цепь) может дать химерный антиген-чувствительный рецептор аналогичного типа. Эти исследования подчеркивают модульность этих рецепторов: соединение нового внеклеточного распознающего элемента с нижележащими внутриклеточными сигнальными элементами приводит к новому датчику ввода / вывода.
Эти CAR первого поколения относительно примитивны и дали неоднозначные результаты. Т-клетки, экспрессирующие CAR, направленные против опухолевых антигенов, обладают умеренной сигнальной способностью по сравнению с эндогенными ответами TCR, умеренно пролиферируют ex vivo и in vivo и имеют низкую выживаемость при многократном воздействии антигена [16,17]].Улучшения в этом поведении были сделаны путем включения дополнительных модульных доменов во внутриклеточные области CARs, включая домены от молекул корецепторов, которые являются частью нормальной активации TCR, таким образом, возможно, имитируя более полную активированную внутриклеточную сборку [40,41]. Клетки, содержащие CAR следующего поколения, более эффективно контролируют опухоли ксенотрансплантата у мышей, и в настоящее время переносятся на клинические испытания [16]. Более сложная инженерия CAR может привести к еще большему улучшению терапевтической функции.
Датчики, которые обнаруживают физические сигналы, такие как свет
Еще одна интересная область исследований — разработка генетически закодированных датчиков, которые могут обнаруживать свет и преобразовывать его в конкретный биологический ответ, область, называемая оптогенетикой. Встречающиеся в природе светочувствительные белки растений, водорослей и бактерий можно модифицировать для использования в высших организмах, включая млекопитающих. Эти инструменты чрезвычайно полезны в качестве пространственно-временных шкал для контроля и анализа сложного клеточного и организменного поведения, особенно когда они экспрессируются с помощью промоторов, специфичных для клеточного типа.В долгосрочной перспективе оптогенетические инструменты могут использоваться для удаленного контроля клеток, используемых в терапевтических целях, хотя существуют серьезные технические проблемы, такие как то, как свет может доставляться в организм, которые необходимо будет преодолеть. Наиболее часто используемые сегодня оптогенетические инструменты — это белки микробного канала родопсин и галородопсин, которые широко используются для контроля функции нейронов. Они рассмотрены в другом месте [42] и не будут здесь подробно обсуждаться.
Совсем недавно появились дополнительные оптогенетические инструменты, которые могут быть применены к более широкому спектру клеточных сигнальных систем.Airan et al. Сконструировали набор активируемых светом GPCRs, которые могут связываться как с нижележащими Gs, так и с гетеротримерными G-белками Gq [43]. Были созданы химеры светочувствительной зрительной системы GPCR, родопсин (бычий), которые содержат внутриклеточные петли от Gq- и Gs-сопряженных адренергических рецепторов. Эндогенная молекула сетчатки — это светочувствительный хромофор. Эти новые инструменты значительно расширяют «словарь» передачи сигналов, которым можно управлять с помощью света, учитывая важность путей передачи сигналов Gq и Gs в различных типах клеток.
Еще более обобщенная стратегия управления светом включает использование контролируемых светом белковых взаимодействий. Временное взаимодействие конкретных белков-партнеров является основой многих внутриклеточных сигнальных событий (см. Ниже), и рецепторы могут быть обойдены, так что свет напрямую контролирует такие внутриклеточные взаимодействия. Левская и др. Использовали систему взаимодействия фитохрома, полученную из растений — связывание этого фоторецептора с его партнерским доменом PIF может включаться и выключаться с помощью определенных длин волн света — для рекрутирования определенных белков на мембрану точным пространственно-временным образом [44].В случае факторов обмена гуаниновых нуклеотидов (GEF), которые контролируют GTPases семейства Rho, это может быть использовано для запуска активации GTPase и последующих изменений цитоскелета, приводящих к световодному выпячиванию клеток. Хотя этот метод является мощным и потенциально применимым ко многим сигнальным взаимодействиям, система Phy-PIF требует добавления проницаемого для клетки хромофора, который не является эндогенным для клеток млекопитающих. Wu et al. Использовали светочувствительный домен LOV (свет-кислород-напряжение) (обнаруженный в растениях, водорослях и бактериях) для конформационной закупорки Rac GTPase контролируемым светом способом [45].Этот связывающий флавин домен обеспечивает еще один потенциально общий конформационный элемент управления светом, который может быть связан для управления различными сигнальными белками.
Инженерные системы обработки сигналов
В конечном итоге клетки решают, какие программы ответа выполнять на основе внутриклеточных сигнальных сетей, которые принимают и обрабатывают сигналы от сенсорных молекул (см. Выше). Недавняя работа в области сотовой инженерии была сосредоточена на понимании того, как эти сети функционируют для принятия решений и как их можно изменить.
Модульная логика обработки сигналов
Внутриклеточные сигнальные белки имеют высокую модульность (см. Выше). Большинство модулей делятся на два класса (). Первый класс — это ферментные домены, такие как киназы и фосфатазы, которые катализируют посттрансляционные модификации или конформационные изменения, с помощью которых сохраняется информация. В большинстве случаев эти каталитические домены входят в пары: ферменты-писатели (например, киназы) производят модификацию, а ферменты-стиратели (например, фосфатазы) удаляют модификацию.Второй класс — это регуляторные домены или домены взаимодействия, которые модулируют активность каталитических доменов или нацеливают их на конкретных партнеров или сайты в клетке. Эти модули могут опосредовать специфические белок-белковые взаимодействия (либо конститутивные взаимодействия, либо те, которые зависят от посттрансляционных модификаций, таких как фосфорилирование) или белок-мембранные взаимодействия. Таким образом, именно регуляторные домены и домены взаимодействия определяют, когда и где активируются каталитические домены и каким партнерам они передают информацию [5].
Модульная логика компонентов внутриклеточной сигнализацииa | ферментных и регуляторных доменов . Модульные сигнальные белки эукариот обычно состоят из ферментативных доменов и доменов локализации. Ферментные домены, такие как киназы и фосфатазы, а также GEF и GAP, катализируют регуляторные модификации, такие как фосфорилирование и активация GTPase, соответственно (ферментные домены часто входят в пары «писатель» и «стиратель», которые имеют противоположные активности).Эти ферментные домены регулируются и нацелены на домены взаимодействия, включая домены межбелкового взаимодействия, домены мембранного взаимодействия или трансмембранные домены.
b | различных классов многодоменных архитектур . Ферментативные домены могут быть непосредственно нацелены на определенные субстраты, партнеров или субклеточные участки посредством доменов взаимодействия. В качестве альтернативы они могут быть косвенно нацелены через адаптеры или белки каркаса, которые содержат несколько доменов взаимодействия.Домены взаимодействия могут также аллостерически регулировать каталитические домены, участвуя во внутримолекулярных аутоингибиторных взаимодействиях. Такие переключающие белки могут быть активированы конкурирующими лигандами, которые снимают аутоингибирование.
Эти разные классы модулей обнаруживаются в различных комбинациях и расположениях в сигнальных белках (). Каталитические домены, слитые с нацеливающими доменами, могут быть задействованы в определенных комплексах или участках мембраны, где они будут модифицировать определенные мишени; часто эти каталитические домены имеют высокую внутреннюю константу Михаэлиса (Km’s и, следовательно, требуют нацеливания с помощью дополнительных доменов взаимодействия для эффективного катализа.Иногда эти нацеленные взаимодействия регулируются, если, например, взаимодействие зависит от посттрансляционной модификации, такой как нацеливание белков домена Sh3 на аутофосфорилированные сайты pTyr на активированных RTK. Белки с двумя доменами взаимодействия могут действовать как адаптеры, которые переводят одно взаимодействие во второе, что приводит к увеличению гибкости ответа в зависимости от адаптерных белков, которые экспрессируются в конкретном типе клеток. Белки с множественными доменами взаимодействия могут также функционировать как скаффолдные белки, которые организуют несколько белков на пути в комплекс.Эти взаимодействия могут быть конститутивными или предопределенными, или индуцированными такими факторами, как фосфорилирование или конформационные изменения, которые открывают сайты взаимодействия. Таким образом, каркасные белки могут в принципе определять проводные связи сигнальных белков, а также контролировать, когда и где происходит передача сигналов [24, 20].
Вторая важная роль взаимодействия и регуляторных доменов — это непосредственный контроль активности каталитических доменов. Во многих случаях домены взаимодействия участвуют во внутримолекулярных аутоингибиторных взаимодействиях, которые стерически закрывают каталитический домен или конформационно возмущают его — тип регуляции, называемый модульной аллостерией [46].Связывание конкурирующих межмолекулярных лигандов с доменами взаимодействия индуцирует каталитическую активность белков. Часто множественные домены взаимодействия участвуют в автоингибировании каталитического домена кооперативным или иерархическим образом [47, 48]. Эти белки могут функционировать как сложные переключатели с множеством входов, которые требуют определенной комбинации входов для правильной активации. Кроме того, поскольку внешние лиганды активируют эти белки, локализация (управляемая этими взаимодействиями) может быть напрямую связана с активацией.
Разработка новых белковых переключателей
Лим и его сотрудники исследовали, можно ли использовать модульную аллостерическую логику многих природных эукариотических сигнальных белков для создания новых сигнальных переключателей путем рекомбинации доменов (). В самом деле, каталитические домены актинового регуляторного белка N-WASP и GEF семейства Rho могут быть связаны с новыми аутоингибиторными доменами с образованием белков, активность которых регулируется новыми лигандами [49,50]. Внутримолекулярное связывание любого из этих каталитических доменов с доменом PDZ и пептидом лиганда PDZ может давать переключатель, который активируется конкурирующим пептидом PDZ.Точно так же можно добавить несколько доменов взаимодействия, чтобы получить комбинаторный переключатель, отображающий управление логическим элементом И. В зависимости от точной конфигурации доменов и внутримолекулярных взаимодействий типы регуляции могут быть разными в ответ на разные конкурирующие внешние лиганды — один лиганд может активировать белок, а другой репрессировать его. Эти типы разнообразных взаимоотношений между регуляторными доменами напоминают разнообразное поведение, наблюдаемое в природных сигнальных белках, подтверждая представление о том, что этот вид архитектуры переключения облегчает эволюцию разнообразных комбинаторных регуляторных переключателей [48].Dueber et al. Также показали, что синтетические аутоингибирующие переключатели, использующие поливалентные взаимодействия одного и того же типа, приводят к переключениям, поведение активации которых может быть настроено кооперативно от линейного до цифрового ответа [51].
Инженерные схемы обработки сигналовa | инженерных переключателей аллостерических белков . Dueber et al [49,51] показали, что аллостерическая регуляция сигнального белка N-WASP может быть перепрограммирована путем рекомбинации каталитического домена из N-WASP с различными комбинациями доменов взаимодействия.Новые модели поведения включали управление с множеством входов (логический элемент И) и активную активацию, подобную переключателю.
b | с использованием белков каркаса в качестве молекулярной печатной платы для преобразования выходных сигналов . Связь входа / выхода киназного пути MAP в дрожжах может быть перенаправлена через сконструированный химерный каркас, который собирает новую комбинацию киназ [58]. Новые сайты взаимодействия также могут быть добавлены к каркасам для привлечения дополнительных модулирующих факторов.Эти дополнительные факторы могут быть построены синтетическими петлями обратной связи, которые могут быть использованы для создания путей, которые отображают разнообразную динамику передачи сигналов [62].
Каркасные белки как молекулярные схемы
Цепи внутриклеточной передачи сигналов также можно напрямую контролировать, используя регуляторные взаимодействия для перепрограммирования соединений путей. Например, каталитический домен киназы семейства Src, Hck, который обычно регулируется доменами Sh3 и Sh4, может быть слит с доменом PDZ и направлен in vivo для специфического фосфорилирования субстратов с мотивом лиганда PDZ [52].
Белки каркаса также могут быть использованы для создания новых взаимосвязей между входом и выходом пути. У дрожжей существует множество функционально различных киназных путей митоген-активированного протеина (MAP), которые регулируют ответы на феромон спаривания и осмотический стресс [53,54]. Эти пути имеют общие компоненты киназ, но остаются специфическими, потому что каждый путь организован отдельным каркасным белком [55–57]. Химерный каркасный белок, который организует избранных членов путей спаривания и осмотического стресса, дает неприродный путь, в котором феромон спаривания специфически индуцирует программу реакции осмостресса в vivo [58].Подобные ковалентные слияния, которые, подобно каркасу, вызывают взаимодействие между двумя сигнальными белками, могут быть использованы для принудительной передачи сигнала по единственному пути [59].
Совсем недавно было показано, что каркасные белки не только опосредуют линейные отношения ввода / вывода путей, но также координируют набор модуляторных факторов, которые формируют дозовую зависимость и динамику ответа пути [60,61]. Вдохновленный этими природными примерами, Башор и др. Показали, что дрожжевой скаффолд MAP-киназы, белок Ste5, можно использовать в качестве молекулярной печатной платы, чтобы гибко изменять количественное поведение реакции спаривания [62].Слияние дополнительного сайта синтетического взаимодействия с каркасом Ste5 (с использованием пары гетеродимеров лейциновой застежки) способствует привлечению новых модулирующих факторов, таких как фосфатаза MAPK, которая подавляет ответ пути. Однако, если экспрессия и рекрутирование фосфатазы связаны с выходным сигналом пути, возникает петля отрицательной обратной связи, которая приводит к адаптации — временный ответ, за которым следует автоматический возврат к более низким уровням выхода, что является ключевым поведением во многих биологических сенсорных системах.Связывая по-разному положительные и отрицательные модуляторы пути, этот небольшой набор элементов управления каркасом может быть использован для генерации очень разнообразных дозовых реакций и динамического поведения, включая высоко кооперативное переключение, отложенные ответы, ускоренные ответы и генерацию импульсов. Эти исследования показывают, как организующие центры, такие как каркас, являются богатой платформой для обработки и формирования внутриклеточной передачи сигналов посредством эволюции или инженерии.
Инженерная пространственная самоорганизация
Один из наиболее плохо изученных аспектов передачи сигналов в клетке — это то, как контуры, состоящие из диффундирующих молекул, могут приводить к высокоточной пространственной организации в клетке, такой как направленная поляризация и миграция.Этот тип самоорганизации является аспектом схемы управления, где нет хороших электронных или инженерных аналогов, и где биология может обучать инженерии.
Инженерные принципы применяются для понимания механизма поляризации почкующихся дрожжей, S. cerevisae . Поляризация контролируется GTPase Cdc42, которая в конечном итоге локализуется в одном сайте материнской клетки, приводя к образованию единственной почки, которая врастает в дочернюю клетку [63].Примечательно, что этот процесс приводит к образованию единственной бутоны почти со 100% надежностью. Цепь положительной обратной связи с участием Cdc42 GTPase является ключевой в поляризации: активный Cdc42 на мембране рекрутирует цитоплазматический белок GEF Bem1, который активирует и локализует дополнительный Cdc42 [64]. Хотя этот вид петли обратной связи ведет к образованию фокусов Cdc42, быстрая диффузия и перераспределение Bem1 между конкурирующими фокусами может быть важным, чтобы позволить одному из фокусов стать доминирующим, что ведет к сингулярности почкования.Эффект замедления диффузии и перераспределения Bem1 за счет связывания его с трансмембранным мотивом был проанализирован [65]. Bem1, привязанный к мембране, может спасти летальность от нокаута Bem1, но не может подвергаться диффузии в цитоплазме. Вместо этого он доставлялся к плазматической мембране в везикулах через актиновые кабели (также координируемые фокусами Cdc42) и от мембранных фокусов посредством эндоцитоза и, таким образом, перераспределялся намного медленнее. Наблюдались серьезные дефекты сингулярности, такие как множество устойчивых конкурирующих фокусов Cdc42, и частота многопочкованных клеток увеличивалась до ~ 5%.Подобные исследования помогают выявить требования к точно контролируемой пространственной самоорганизации и предполагают, что мы можем научиться создавать сигнальные цепи, которые производят индивидуальные пространственные результаты с важным терапевтическим поведением (например, регенеративная медицина, которая требует определенной клеточной морфологии и ориентации).
Создание предсказуемой инженерии передачи сигналов
Исследования, приведенные выше, показывают, что сигнальные системы являются высокомодульными и пластичными и рекомбинирующие модули, особенно каталитические домены с новыми регуляторными доменами, могут приводить к отличному ответному поведению.Таким образом, вопрос уже не в том, можно ли спроектировать сигнальные системы для получения нового поведения, а в том, можно ли их спроектировать таким образом, чтобы мы могли предсказать, какое поведение проявится и насколько успешной будет каждая спроектированная схема.
Проблема непредвиденных перекрестных помех
Одна из основных проблем, связанных с передачей сигналов инженерной клетки, заключается в том, что естественные компоненты — инструментарий доступных доменов — повторно используются, что может привести к непредвиденным перекрестным помехам. Приведут ли инженерные взаимодействия, которые вы создаете, к специфическому фосфорилированию желаемого белка, или используемый домен также будет перекрестно взаимодействовать с другими мишенями, конкурентно титруя важные физиологические взаимодействия и приводя к непредвиденным эффектам или сбоям в спроектированной схеме? Часто природные части не обладают абсолютной специфичностью, и эволюция, скорее всего, использует сложные сети перекрестной реактивности, чтобы обеспечить важную скоординированную регуляцию.Хотя такая сложная система, похожая на нейронную сеть, может обеспечить преимущества для клетки, это проклятие для прогнозной инженерии.
Представляя будущий инструментарий сигнализации
Одним из решений этой проблемы является сборка инструментария из деталей, специально оптимизированных для проектирования. Этот вопрос важен для любого типа сигнальной части, но мы сосредоточимся на том, как собрать полезный инструментарий из частей, взаимодействующих с белками ().
Улучшение инструментария для предсказуемой инженерии клеточной сигнализации: части ортогонального взаимодействияНативная клетка имеет свой собственный репетитор модулей взаимодействия с белками, и поэтому сложно разработать новые функции с использованием связанных модулей взаимодействия, которые могут показывать непреднамеренные и непреднамеренные перекрестные помехи в камере.Оптимизированный набор взаимодействующих частей может значительно повысить предсказуемость клеточной инженерии, исключив возможность непреднамеренных перекрестных помех. Несколько стратегий оптимизации включают разработку модулей взаимодействия, которые используют неиспользованную специфичность; разработка составных, многодоменных взаимодействий; объединение модулей взаимодействия с новым субклеточным нацеливанием; и импорт модулей ортогонального взаимодействия (либо созданных синтетически, либо из других организмов), которых нет в клетке-хозяине.
Хотя природа неоднократно использовала семейства частей, такие как домены взаимодействия определенного типа, недавние исследования показывают, что в некоторых случаях члены семейства содержат неиспользуемые сайты узнавания внутри этих доменов. Их можно использовать для создания пар домен-пептид, которые одновременно оптимизированы для взаимодействия со своим правильным партнером, избегая при этом перекрестного взаимодействия с другими членами семейства [66,67]. Фактически были сконструированы пары PDZ-домен-лиганд и гетеродимеризующиеся пары лейциновой застежки-молнии, которые оптимизированы, чтобы избежать перекрестной реакции с естественными доменами того же типа [68,69].Избирательность и предсказуемость существующих доменов взаимодействия также можно улучшить путем разработки составных взаимодействий. Конечно, многодоменное сотрудничество — естественный механизм повышения специфичности. Но новый поворот в этом вопросе — это разработка составных двухкомпонентных взаимодействий типа «раскладушка». Koide et al. Взяли домен PDZ и слили его с доменом фибронектина [70]. Используя фаговый дисплей, они отобрали варианты этого тандемного домена, которые связывают определенный пептид, так что он находится между двумя доменами.Резко увеличенная площадь распознавания приводит к взаимодействиям с гораздо более высокой специфичностью и сродством. Другое решение для специфичности, которое наблюдается в природе, — это дифференциальная компартментализация. Если нацеливающие мотивы могут быть использованы для локализации партнерских белков в определенных органеллах или клеточных участках, то мотивы взаимодействия, вероятно, будут функционировать более специфическим образом, особенно если в этом месте или органелле происходит мало или совсем не происходит конкурирующих взаимодействий этого типа.
Альтернативный подход к достижению надежной специфичности заключается в импорте доменов из других организмов, которых нет в создаваемом хозяине. Напр., PDZ домены могут быть импортированы в дрожжи (у которых отсутствует большинство таких доменов), хотя возможность случайных перекрестных реагирующих партнеров не может быть исключена [58]. Примером ортогональной молекулярной системы, которая была успешно перенесена на нового хозяина, является бактериальная рекомбиназная система Cre-Lox, которая надежно используется для создания сложных хромосомных перестроек в сложных организмах, включая мышей [71].
Таким образом, представляя инструментарий будущего, можно захотеть создать набор из десяти или около того пар взаимодействия белков, оптимизированных для конкретного выбранного организма (например, E.coli , S.cerevisae , млекопитающие) в том, что они ортогональны, то есть известно, что они не реагируют перекрестно с протеомом хозяина или белками в наборе инструментов, за исключением их родственного лиганда. Также важно, чтобы эти взаимодействия были настраиваемыми, поэтому серия лигандов для каждого домена взаимодействия, которые различаются по аффинности на несколько порядков, были бы идеальными.Это позволило бы систематически исследовать, как сродство вербовки меняет поведение системы.
Комбинаторный дизайн и прогнозирование
Другой другой, но все же дополнительный подход к предсказуемому проектированию передачи сигналов соты состоит в использовании комбинаторной изменчивости. В ходе естественной эволюции рекомбинация сигнальных модулей для генерации новой функции, по-видимому, не была спроектирована или направлена, а скорее была относительно случайной, и именно естественный отбор выявил события перепрограммирования, которые привели к преимуществам приспособленности.Таким образом, очень плодотворным подходом, учитывая отсутствие предсказуемости в клеточной инженерии, могло бы быть построение комбинаторных библиотек синтетических схем и выбор желаемой функции [25,72]. Более того, этот подход можно было бы комбинировать с полу- прогнозное проектирование, при котором могут быть разработаны общие архитектуры спроектированных схем, но комбинаторные методы используются для поиска в более широком диапазоне пространства параметров (с использованием вариантов каждого модуля в библиотеке). Сосредоточение внимания на комбинаторном выборе может также обеспечить очень полезную стратегию на заре синтетической биологии, поскольку это может помочь нам быстрее узнать о основных принципах проектирования.
Outlook
Цель понимания того, как клетки общаются и принимают решения, остается очень привлекательной, особенно потому, что понимание молекулярного языка внутри клетки может позволить нам общаться с клетками и инструктировать их выполнять новые запрограммированные функции. Наша способность перестраивать клеточную сигнализацию может обеспечить множество мощных приложений, таких как терапевтические клетки, запрограммированные на обнаружение селективного набора сигналов, связанных с заболеванием, и на локальный ответ точно настроенным образом.
Хотя эволюция достигла такого рода инноваций и точной инженерии клеточных функций, мы только начинаем понимать, как достичь такого рода цели. У нас есть хорошее фундаментальное понимание логики клеточных сигнальных механизмов и источников функциональной пластичности. Кроме того, были сделаны первые важные шаги в разработке новых рецепторно-сенсорных систем, а также новых или модифицированных схем обработки внутриклеточных сигналов. Несмотря на эти инструменты, на сегодняшний день было приложено очень мало усилий для того, чтобы связать эти типы компонентов новыми способами, чтобы получить более крупные интегральные схемы, способные давать очень точные и точные отклики.Такие усилия продолжаются. Например, Cell Propulsion Lab — это наномедицинский центр Национального института здравоохранения (http://nihroadmap.nih.gov/nanomedicine/devcenters/cellularcontrol.asp), который пытается использовать относительно простые противоопухолевые иммунные клетки, созданные с использованием синтетических рецепторов химерных антигенов ( CAR), и улучшают обработку их сигналов и набор ответов, которые они вызывают, чтобы оптимизировать клетки для экспансии ex vivo, , in vivo, выживания, противоопухолевой цитотоксичности и нарушения благоприятного микроокружения опухоли.Будет интересно увидеть, как будут развиваться эти типы усилий и как эти проблемы повысят сложность и надежность сотовой инженерии.
Новейшие инженерные датчики сигнализацииa | перенаправление собственных входов на новые выходы . С-концевой домен рецептора notch представляет собой фактор транскрипции, который высвобождается в результате трансмембранного протеолиза при активации лигандом дельта. Замена альтернативным доменом фактора транскрипции дает новый ответ экспрессии гена [26].Выход рецептора, сопряженного с G-белком (GPCR), может быть перенаправлен аналогичным образом путем слияния домена фактора транскрипции через привязку с сайтом протеазы TEV. Активация GPCR приводит к привлечению белка аррестина. Если в клетке экспрессируется слияние протеазы аррестин-TEV, активация GPCR приводит к высвобождению фактора транскрипции и новому выходу экспрессии гена [28]. Таким образом, активация GPCR может быть произвольно связана с новым транскрипционным выходом. Выход рецепторной тирозинкиназы (RTK) может быть перенаправлен за счет привлечения синтетических адаптеров домена Sh3 или PTB к активированному и фосфорилированному тирозин рецептору.Домен Sh3 может быть использован для рекрутирования протеазы TEV (чтобы снова высвободить искусственно связанный транскрипционный домен) [28] или для рекрутирования новых эффекторных доменов, таких как те, которые участвуют в гибели клеток [29].
b | инженерный новаторский контроль ввода для собственных ответов . GPCR были сконструированы так, чтобы их контролировали низкомолекулярные агонисты путем мутации их внеклеточной поверхности, так что они больше не связывают свои эндогенные лиганды (рецепторы, активируемые исключительно синтетическим лигандом — RASSL [32]).Рецепторы, которые активируют Т-клетки в ответ на произвольные входные данные, могут быть созданы путем слияния сконструированных одноцепочечных антител (scFv) с внутриклеточной областью Т-клеточного рецептора (дзета-цепь CD3), которые называются рецепторами химерных антигенов (CARs [16, 17]). Событие передачи сигнала, опосредованное рекрутингом, может быть помещено под световой контроль путем замены эндогенного взаимодействия на светозащитное взаимодействие, пара взаимодействий Phytochrome-PIF от растений [44].
Инженерно-пространственное регулированиеa | Цепь поляризации дикого типа контролирует образование одиночных почек. В почкующихся дрожжах локализованная активация полярности GTPase Cdc42 усиливается петлей положительной обратной связи — активный Cdc42 рекрутирует каркасный белок Bem1, совместно собирает активированную p21 киназу (PAK — Ste20) и Cdc42 GEF (Cdc24). Хотя клетка может иметь несколько фокусов Cdc42, они быстро распадаются на один доминантный фокус, который развивается только в клетки. Предполагается, что быстрая скорость обмена диффундирующим комплексом Bem1 / PAK / GEF между конкурирующими фокусами Cdc42 является критической для разделения в один доминантный фокус.
b | синтетическая цепь медленной поляризации приводит к образованию множественных бутонов . Чтобы проверить эту гипотезу, Bem1 был искусственно привязан к мембране через слитый мотив нацеливания на мембрану [65]. Хотя этот связанный с мембраной Bem1 может должным образом собирать комплекс Bem1 / PAK / GEF на участках активности Cdc42 (т.е. петле положительной обратной связи), обмен комплексом между конкурирующими фокусами Cdc42 происходит медленно (зависит от везикулярного транспорта через актиновые кабели и эндоцитоза) .Эта синтетическая поляризационная схема, следовательно, приводит к плохому разрешению конкурирующих фокусов Cdc42 и гораздо более высокой частоте (5% против ~ 0%) многопучковых клеток (микрофотографии из [65]).
Ссылки
2. Киль Ч., Юс Э., Серрано Л. Инженерные пути передачи сигналов. Клетка. 2010. 140 (1): 33–47. [PubMed] [Google Scholar] 3. Sprinzak D, Elowitz MB. Реконструкция генетических цепей. Природа. 2005; 438: 443–8. [PubMed] [Google Scholar] 4. Мукхерджи С., ван Ауденаарден А. Синтетическая биология: понимание биологического дизайна из синтетических цепей.Nat Rev Genet. 2009; 10: 859–71. [Бесплатная статья PMC] [PubMed] [Google Scholar] 5. Башор CJ, Хорвиц AA, Peisajovich SG, Lim WA. Перепрограммирование клеток: синтетическая биология как инструмент для исследования организационных принципов живых систем. Анну Рев Биофиз. 2010 16 февраля; [Epub перед печатью] [Бесплатная статья PMC] [PubMed] [Google Scholar] 6. Yeh BJ, Lim WA. Синтетическая биология: уроки истории синтетической органической химии. Nat Chem Biol. 2007; 3: 521–5. [PubMed] [Google Scholar] 7. Вайнберг Р. Биология рака.Наука о гирляндах; 2006. [Google Scholar] 9. Мюнтер С., Вэй М., Фришкнехт Ф. Сигнализация во время инфекции патогена. Sci STKE. 2006; 2006: re5. [PubMed] [Google Scholar] 10. Shan L, He P, Sheen J. Перехват сигнальных каскадов MAPK хозяина с помощью бактериальных эффекторов III типа. Клеточный микроб-хозяин. 2007; 1: 167–74. [PubMed] [Google Scholar] 11. Кискинис Э., Эгган К. Прогресс в клиническом применении плюрипотентных стволовых клеток для конкретных пациентов. J Clin Invest. 2010; 120: 51–9. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12.Линдвалл О., Кокая З. Стволовые клетки при нейродегенеративных расстройствах человека — время для клинического перевода? J Clin Invest. 2010; 120: 29–40. [Бесплатная статья PMC] [PubMed] [Google Scholar] 14. Варела-Рохена А., Карпенито С., Перес Э., Ричардсон М., Парри Р., Милон М., Шоллер Дж., Хао Х, Мексас А., Кэрролл Р. Г., Чемпион июня, Райли Дж. Л.. Генная инженерия Т-клеток для адоптивной иммунотерапии. Immunol Res. 2008; 42: 166–81. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Ли С.К., Чжоу Х., Хэм Т.С., Ли Т.С., Кизлинг Д.Д. Метаболическая инженерия микроорганизмов для производства биотоплива: от насекомых до синтетической биологии и топлива.Curr Opin Biotechnol. 2008; 19: 556–63. [PubMed] [Google Scholar] 16. Sadelain M, Brentjens R, Rivière I. Перспективы и потенциальные ловушки химерных антигенных рецепторов. Curr Opin Immunol. 2009; 21: 215–23. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Tlsty TD, Coussens LM. Строма опухоли и регуляция развития рака. Анну Рев Патол. 2006; 1: 119–50. [PubMed] [Google Scholar] 19. Поусон Т., Нэш П. Сборка клеточных регуляторных систем через домены взаимодействия белков. Наука. 2003; 300: 445–52.[PubMed] [Google Scholar] 20. Бхаттачарья Р.П., Ременьи А., Йе Б.Дж., Лим В.А. Домены, мотивы и каркасы: роль модульных взаимодействий в эволюции и подключении сигнальных цепей клетки. Анну Рев Биохим. 2006; 75: 655–80. [PubMed] [Google Scholar] 23. Кэрролл С.Б. Эво-дево и расширяющийся эволюционный синтез: генетическая теория морфологической эволюции. Клетка. 2008. 134: 25–36. [PubMed] [Google Scholar] 24. Скотт Дж. Д., Поусон Т. Передача сигналов в клетках в пространстве и времени: где белки объединяются, а когда разделяются.Наука. 2009; 326: 1220–4. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Пейсайович С., Гарбарино Дж., Вей П., Лим В.А. Быстрая диверсификация сигнальных фенотипов клеток за счет рекомбинации модульных доменов. Наука. в прессе. [Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Struhl G, Adachi A. Ядерный доступ и действие notch in vivo. Клетка. 1998. 93: 649–60. [PubMed] [Google Scholar] 27. Спринзак Д., Лакханпал А., ЛеБон Л., Сантат Л.А., Фонтес М.Э., Андерсон Г.А., Гарсия-Охалво Дж., Эловиц МБ. Цис-взаимодействия между Notch и Delta создают взаимоисключающие сигнальные состояния.Природа. в прессе. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Barnea G, Strapps W, Herrada G, Berman Y, Ong J, Kloss B, Axel R, Lee KJ. Генетический дизайн сигнальных каскадов для регистрации активации рецепторов. Proc Natl Acad Sci USA. 2008; 105: 64–9. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Howard PL, Chia MC, Del Rizzo S, Liu FF, Pawson T. Перенаправление передачи сигналов тирозинкиназы на путь апоптоза каспазы через химерные адаптерные белки. Proc Natl Acad Sci U S. A. 2003; 100: 11267–72.[Бесплатная статья PMC] [PubMed] [Google Scholar] 30. Conklin BR, Hsiao EC, Claeysen S, Dumuis A, Srinivasan S, Forsayeth JR, Guettier JM, Chang WC, Pei Y, McCarthy KD, Nissenson RA, Wess J, Bockaert J, Roth BL. Разработка сигнальных путей GPCR с помощью RASSL. Нат методы. 2008; 5: 673–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31. Армбрустер Б.Н., Ли Х, Пауш М.Х., Херлитце С., Рот Б.Л. Доработка замка для соответствия ключу для создания семейства рецепторов, связанных с G-белком, активно активируемых инертным лигандом.Proc Natl Acad Sci U S. A. 2007; 104: 5163–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 32. Трус П., Вада Х.Г., Фальк М.С., Чан С.Д., Мэн Ф., Акил Х., Конклин Б.Р. Управление передачей сигналов с помощью специально разработанного Gi-связанного рецептора. Proc Natl Acad Sci U S. A. 1998; 95: 352–7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 33. Zhao GQ, Zhang Y, Hoon MA, Chandrashekar J, Erlenbach I., Ryba NJ, Zuker CS. Рецепторы сладкого вкуса и вкуса умами млекопитающих. Клетка. 2003. 115: 255–66. [PubMed] [Google Scholar] 34. Redfern CH, Coward P, Дегтярев М.Ю., Lee EK, Kwa AT, Hennighausen L, Bujard H, Fishman GI, Conklin BR.Условная экспрессия и передача сигналов специально сконструированного Gi-сопряженного рецептора у трансгенных мышей. Nat Biotechnol. 1999; 17: 165–9. [PubMed] [Google Scholar] 35. Корсон Т.В., Аберли Н., Экипаж СМ. Дизайн и применение бифункциональных малых молекул: почему две головы лучше, чем одна. ACS Chem Biol. 2008; 3: 677–692. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Поллок Р., Клэксон Т. Экспрессия гена, регулируемая димеризером. Curr Opin Biotechnol. 2002; 13: 459–67. [PubMed] [Google Scholar] 37. Ирвинг Б.А., Вайс А.Цитоплазматического домена дзета-цепи Т-клеточного рецептора достаточно для соединения с рецептор-ассоциированными путями передачи сигнала. Клетка. 1991; 64: 891–901. [PubMed] [Google Scholar] 38. Гросс Г., Горохов Г., Вакс Т., Эшхар З. Создание эффекторных Т-клеток, экспрессирующих химерный Т-клеточный рецептор со специфичностью типа антитела. Transplant Proc. 1989; 21: 127–30. [PubMed] [Google Scholar] 39. Eshhar Z, Waks T, Bendavid A, Schindler DG. Функциональная экспрессия генов химерных рецепторов в Т-клетках человека. J Immunol Methods.2001; 248: 67–76. [PubMed] [Google Scholar] 40. Maher J, Brentjens RJ, Gunset G, Rivière I, Sadelain M. Цитотоксичность и пролиферация Т-лимфоцитов человека, управляемые одним химерным рецептором TCRzeta / CD28. Nat Biotechnol. 2002; 20: 70–5. [PubMed] [Google Scholar] 41. Карпенито К., Милоне М.К., Хассан Р., Симонет Дж. К., Лакхал М., Сухоски М. М., Варела-Рохена А., Хейнс К. М., Хейтджан Д. Ф., Альбельда С. М., Кэрролл Р. Г., Райли Дж. Л., Пастан I, Джун Чемпион. Контроль крупных установленных ксенотрансплантатов опухолей с генетически перенаправленными человеческими Т-клетками, содержащими домены CD28 и CD137.Proc Natl Acad Sci U S. A. 2009; 106: 3360–5. [Бесплатная статья PMC] [PubMed] [Google Scholar] 42. Чжан Ф., Араванис А.М., Адамантидис А., де Лесеа Л., Дейссерот К. Автоматические выключатели: оптические технологии для исследования нейронных сигналов и систем. Nat Rev Neurosci. 2007; 8: 577–81. [PubMed] [Google Scholar] 43. Airan RD, Thompson KR, Fenno LE, Bernstein H, Deisseroth K. Временный контроль внутриклеточной передачи сигналов in vivo. Природа. 2009; 458: 1025–9. [PubMed] [Google Scholar] 44. Левская А, Вайнер О.Д., Лим В.А., Фойгт CA.Пространственно-временной контроль клеточной передачи сигналов с использованием переключаемого светом белкового взаимодействия. Природа. 2009; 461: 997–1001. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Wu YI, Frey D, Lungu OI, Jaehrig A, Schlichting I., Kuhlman B, Hahn KM. Генетически кодируемый фотоактивируемый Rac контролирует подвижность живых клеток. Природа. 2009; 461: 104–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 46. Lim WA. Модульная логика сигнальных белков: построение аллостерических переключателей из простых связывающих доменов. Curr Opin Struct Biol.2002; 12: 61–8. [PubMed] [Google Scholar] 47. Prehoda KE, Scott JA, Mullins RD, Lim WA. Интеграция нескольких сигналов посредством совместной регуляции комплекса N-WASP-Arp2 / 3. Наука. 2000; 290: 801–6. [PubMed] [Google Scholar] 48. Ю Б., Мартинс И.Р., Ли П., Амарасинге Г.К., Уметани Дж., Фернандес-Запико М.Э., Билладо Д.Д., Мачиус М., Томчик Д.Р., Розен М.К. Структурные и энергетические механизмы кооперативного аутоингибирования и активации Vav1. Клетка. 2010. 140: 246–56. [Бесплатная статья PMC] [PubMed] [Google Scholar] 49.Dueber JE, Yeh BJ, Chak K, Lim WA. Перепрограммирование управления переключателем аллостерической сигнализации посредством модульной рекомбинации. Наука. 2003; 301: 1904–8. [PubMed] [Google Scholar] 50. Йе Би Джей, Рутильяно Р. Дж., Деб А., Бар-Саги Д., Лим ВА. Перестройка путей клеточной морфологии с помощью факторов обмена синтетических гуаниновых нуклеотидов. Природа. 2007. 447: 596–600. [PubMed] [Google Scholar] 51. Дуэбер Дж. Э., Мирский Е. А., Лим В. А.. Разработка синтетических сигнальных белков со сверхчувствительным управлением вводом / выводом. Nat Biotechnol.2007; 25: 660–2. [PubMed] [Google Scholar] 52. Ядав С.С., Йе Б.Дж., Крэддок Б.П., Лим В.А., Миллер В.Т. Реинжиниринг сигнальных свойств киназы семейства Src. Биохимия. 2009. 48: 10956–62. [Бесплатная статья PMC] [PubMed] [Google Scholar] 53. Гаррингтон Т.П., Джонсон Г.Л. Организация и регуляция сигнальных путей митоген-активируемой протеинкиназы. Curr Opin Cell Biol. 1999; 11: 211–8. [PubMed] [Google Scholar] 54. Шварц М.А., Мадхани HD. Принципы специфичности передачи сигналов MAP-киназы у Saccharomyces cerevisiae.Анну Рев Жене. 2004. 38: 725–48. [PubMed] [Google Scholar] 55. Чой К.Ю., Саттерберг Б., Лион DM, Элион Э.А. Ste5 связывает несколько протеинкиназ в каскаде MAP-киназ, необходимых для спаривания у S. cerevisiae. Клетка. 1994. 78 (3): 499–512. [PubMed] [Google Scholar] 56. Printen JA, Sprague GF., Jr. Белковые взаимодействия в пути ответа феромонов дрожжей: Ste5p взаимодействует со всеми членами каскада киназ MAP. Генетика. 1994. 138 (3): 609–19. [Бесплатная статья PMC] [PubMed] [Google Scholar] 57. Посас Ф, Сайто Х.Осмотическая активация пути HOG MAPK через Ste11p MAPKKK: роль каркаса Pbs2p MAPKK. Наука. 1997. 276 (5319): 1702–5. [PubMed] [Google Scholar] 58. Park SH, Zarrinpar A, Lim WA. Перестройка путей MAP-киназы с использованием альтернативных механизмов сборки каркаса. Наука. 2003; 299: 1061–4. [PubMed] [Google Scholar] 59. Харрис К., Ламсон Р.Е., Нельсон Б., Хьюз Т.Р., Мартон М.Дж., Робертс С.Дж., Бун С., Прайчак П.М. Роль каркасов в специфичности пути киназы MAP, выявленная путем индивидуального дизайна сигнальных белков, предназначенных для этого пути.Curr Biol. 2001. 11 (23): 1815–24. [PubMed] [Google Scholar] 60. Dodge-Kafka KL, Soughayer J, Pare GC, Carlisle Michel JJ, Langeberg LK, Kapiloff MS, Scott JD. Заякоренный белок mAKAP протеинкиназы А координирует два интегрированных эффекторных пути цАМФ. Природа. 2005. 437 (7058): 574–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 61. Мишра П., Соколич М., Уолл М.А., Грейвс Дж., Ван З., Ранганатан Р. Динамическое формирование каркаса в системе передачи сигналов, связанной с G-белком. Клетка. 2007. 131 (1): 80–92. [PubMed] [Google Scholar] 62.Башор CJ, Helman NC, Yan S, Lim WA. Использование инженерных взаимодействий каркаса для изменения динамики передачи сигналов пути киназы MAP. Наука. 2008. 319 (5869): 1539–43. [PubMed] [Google Scholar] 63. Чант Дж. Полярность клеток в дрожжах. Annu Rev Cell Dev Biol. 1999; 15: 365–91. [PubMed] [Google Scholar] 64. Козубовски Л., Сайто К., Джонсон Дж. М., Хауэлл А. С., Зила Т. Р., Лью Д. Д.. Поляризация, нарушающая симметрию, управляемая комплексом Cdc42p GEF-PAK. Curr Biol. 2008. 18 (22): 1719–26. [Бесплатная статья PMC] [PubMed] [Google Scholar] 65. Howell AS, Savage NS, Johnson SA, Bose I, Wagner AW, Zyla TR, Nijhout HF, Reed MC, Goryachev AB, Lew DJ.Необычность в поляризации: перестройка дрожжевых клеток для образования двух бутонов. Клетка. 2009. 139 (4): 731–43. [Бесплатная статья PMC] [PubMed] [Google Scholar] 66. Зарринпар А, Парк SH, Лим WA. Оптимизация специфичности в сети взаимодействия белков клетки путем отрицательного отбора. Природа. 2003. 426 (6967): 676–80. [PubMed] [Google Scholar] 67. Stiffler MA, Chen JR, Grantcharova VP, Lei Y, Fuchs D, Allen JE, Zaslavskaia LA, MacBeath G. Селективность связывания домена PDZ оптимизирована по протеому мыши. Наука. 2007. 317 (5836): 364–9.[Бесплатная статья PMC] [PubMed] [Google Scholar] 68. Эрнст А., Сазинский С.Л., Хуэй С., Каррелл Б., Дхарси М., Сешагири С., Бадер Г.Д., Сидху С.С. Быстрая эволюция функциональной сложности в семействе доменов. Sci Signal. 2009; 2 (87): ра50. [PubMed] [Google Scholar] 69. Григорян Г., Рейнке А.В., Китинг А.Е. Дизайн специфичности взаимодействия с белками дает селективные bZIP-связывающие пептиды. Природа. 2009. 458 (7240): 859–64. [Бесплатная статья PMC] [PubMed] [Google Scholar] 70. Хуанг Дж., Коиде А., Макабе К., Коиде С. Дизайн скачков функции белка путем направленной эволюции интерфейса домена.Proc Natl Acad Sci U S. A. 2008; 105 (18): 6578–83. [Бесплатная статья PMC] [PubMed] [Google Scholar] 71. Зауэр Б. Индуцируемое нацеливание гена у мышей с использованием системы Cre / lox. Методы. 1998. 14 (4): 381–92. [PubMed] [Google Scholar]Разработка индивидуальных сигнальных цепей клеток
Nat Rev Mol Cell Biol. Авторская рукопись; доступно в PMC 2010 8 ноября.
Опубликован в окончательной отредактированной форме как:
PMCID: PMC2975372
NIHMSID: NIHMS246517
Wendell A.Lim
HHMI и отдел клеточной и молекулярной фармакологии, UCSF, The Cell Propulsion Lab, NIH Nanomedicine Development Center, NSF Synthetic Biology Engineering Research Center
Венделл А. Лим, HHMI и отдел клеточной и молекулярной фармакологии, UCSF , Лаборатория движения клеток, Центр разработки наномедицины NIH, Исследовательский центр синтетической биологии NSF;
См. Другие статьи в PMC, в которых цитируется опубликованная статья.Abstract
Живые клетки развили широкий спектр сложных сигнальных реакций, которые позволяют им выживать в различных условиях окружающей среды и выполнять определенные физиологические функции.Наше все более сложное понимание молекулярных механизмов клеточных сигнальных сетей у эукариот выявило удивительно модульную организацию, и синтетические биологи изучают, как это можно использовать для создания клеток с новым сигнальным поведением. Этот подход начинает раскрывать логику того, как клетки могут развивать инновационные новые функции, и подталкивает нас к захватывающей возможности создания пользовательских клеток с точными функциями восприятия и реакции, которые могут быть полезны в медицине и биотехнологии.
Ключевые слова: передача сигналов клеток, инженерия, синтетическая биология, терапевтический, MAP-киназа, каркас, модули, белковые взаимодействия, N-WASP, рецепторы, GPCR, Notch, RTK, рак, адоптивная иммунотерапия, химерные антигенные рецепторы, Т-клетки. , оптический контроль, биопродукция
Живые клетки — это высокодинамичные системы, которые используют сложные молекулярные сигнальные цепи для мониторинга внешнего и внутреннего состояния и выполнения соответствующих физиологических реакций. Как и любая сенсорная машина, созданная или созданная человеком, эти клеточные сигнальные цепи содержат подсистемы принятия решений, которые действуют как сенсоры и процессоры (например, рецепторы и их последующие эффекторы), которые в конечном итоге контролируют различные подсистемы ответа (такие как транскрипция генов и динамика цитоскелета) ( ).Основная цель современной клеточной биологии — понять, как эти молекулярные сигнальные системы достигают своих сложных ответов, которые оптимально настроены для их физиологической роли. Хотя подавляющее большинство исследований нацелено на анализ, картирование и анализ сигнальных сетей клеток, наше растущее понимание того, как работают эти системы, привело к появлению радикально нового подхода — усилий по разработке и созданию собственных синтетических сигнальных цепей [1,2 ].
Общая организация и поведение сигнальных цепей ячеекa | Клетки обычно воспринимают стимулы окружающей среды через рецепторы и другие датчики .Затем эта информация обрабатывается внутриклеточными сигнальными сетями, которые, в свою очередь, задействуют различные клеточные продукты, включая экспрессию генов, секрецию, изменения цитоскелета и рост клеток.
b | Некоторые из основных проблем в развитии или разработке новых сигнальных цепей: : достижение правильной связи определенных входов и конкретных выходов; настройка количественного поведения сигнального ответа — доза-реакция и динамика — так, чтобы они были оптимальными для физиологической функции; и создание устойчивых пространственно самоорганизующихся процессов, таких как процессы, связанные с поляризацией клеток, направленной подвижностью, делением клеток и компартментализацией клеток.
Здесь мы сосредоточимся на синтетической биологии передачи сигналов и посмотрим, как можно спроектировать сигнальные схемы эукариотических клеток для создания клеток с заданным поведением передачи сигналов. Эукариотические клетки используют сети сигнальных белков, чтобы ощущать окружающую их среду и обеспечивать быстрые ответы. Поскольку сети обработки сигналов в клетках функционируют в трехмерном пространстве, они также контролируют сложные пространственные или морфологические клеточные реакции. Мы рассмотрим, как могут быть созданы сигнальные цепи с точным поведением реакции, учитывая, как определяется специфичность ответа (то есть, какие наборы выходных сигналов связаны с конкретным входом), как точно настроенная доза-реакция или временная динамика профили ответов оптимизированы для конкретных физиологических функций и того, как можно достичь сложного пространственного и морфологического контроля ().Мы также рассмотрим, почему появились усилия по разработке и созданию специализированных синтетических сигнальных цепей, как они могут обеспечить более глубокое видение принципов и механизмов разработки молекулярных сигнальных систем и как индивидуализированные реакции на поведение могут быть применены в медицине и биотехнологии. Наконец, мы рассматриваем, как в будущем могут быть разработаны инструменты и методы, которые упростят разработку клеточного поведения.
Почему инженерная сигнализация ячейки?
Прежде чем рассматривать конкретные примеры сконструированных сигнальных путей, полезно обсудить мотивацию инженерии клеточной сигнализации.Попытка создать новое сигнальное поведение в клетках может показаться смелой и глупой целью, учитывая, что у нас еще нет полного или надежного предсказательного понимания естественных сигнальных цепей клеток. Однако разработка клеточной сигнализации — это не просто процесс применения уже хорошо разработанного понимания, но она предлагает подход к «пониманию через построение». В то время как биология традиционно была наукой анализа и деконструкции для выявления генов и молекул, которые важны для конкретного процесса, синтетическая биология предлагает обратный подход, фокусируясь на том, как отдельные молекулярные части могут быть собраны в системы, которые выполняют сложное поведение.Поскольку в настоящее время у нас есть полностью секвенированные геномы и огромное количество протеомных данных, нам не хватает не полного списка молекулярных частей, а скорее понимания того, как эти части сочетаются друг с другом функционально согласованным образом. Разработка новых сигнальных сетей клеток предлагает нам подход к тестированию и расширению нашего понимания принципов организации сложных молекулярных систем.
В этом смысле синтетическая биология передачи сигналов не просто ориентирована на достижение цели приложения, такой как построение клетки с целевой функцией, но также является исследовательской наукой, в которой важно понимать, какие конструкции «работают». и как они соотносятся с «неработающими» дизайнами.Если, например, у кого-то есть естественная сигнальная сеть, которая выполняет сложное представляющее интерес поведение, традиционная генетическая деконструкция может использоваться для идентификации молекул и связей, которые необходимы и важны для функции (). Однако затем можно использовать синтетические подходы для систематического изучения многих типов изменений — альтернативных сетевых связей, настройки силы связей, добавления новых связей — для проверки того, какие сети совместимы с этим интересующим поведением. Анализируя естественную сеть или проектируя единственную успешную схему, вряд ли можно получить более глубокое понимание функционального ландшафта, которое может дать более полное и систематическое исследование синтетической схемы () [3–5].В этом смысле попытки спроектировать клеточное поведение сродни ранней истории синтетической органической химии, где синтез новых или модифицированных молекул обеспечил дополнительный подход к химическому анализу в развитии фундаментальных теорий химической связи, структуры и реакционной способности [ 6]
Зачем менять схемы сигнальных цепей ячеек?и | понимание принципов дизайна. Традиционно для анализа сигнальной сети используются такие методы, как нарушение гена.Синтетические подходы предлагают дополнительную информацию, создавая альтернативные версии сети, которые различаются как подключением к сети, так и мощностью каналов. Сопоставляя пространство функциональных (красные кружки) и нефункциональных (синие кружки) вариантов, можно получить более глубокое понимание функциональных требований.
b | конструирует дизайнерские сигнальные пути для терапевтических или биотехнологических приложений. Мы надеемся собрать набор сигнальных модулей, которые можно использовать для создания ячеек со спроектированными сигнальными ответами.Противораковая клетка может обнаруживать комбинацию сигналов опухоли и давать такие ответы, как выработка реагентов для визуализации, уничтожение клеток или секреция факторов, нарушающих микросреду опухоли. Такая ячейка может также иметь предохранительные выключатели, которые могли бы отключить ячейку при необходимости. Иммуносупрессивная клетка может обнаруживать комбинацию аутоиммунного ответа или сигналов отторжения трансплантата и запускать локальные контрмеры, такие как секреция противовоспалительных цитокинов. Интеллектуальная биопродуктивная (ферментационная) клетка будет спроектирована так, чтобы точно модулировать поток роста по сравнению с производственными путями в ответ на стрессовое состояние клетки, тем самым оптимизируя общий урожай.
Изучение пластичности сигнальных путей и того, как их функции могут быть настроены, также имеет отношение к патологии и лечению заболеваний. Многие виды рака обладают онкогенными мутациями, которые эффективно «переплетают» сигнальные сети клеток, контролирующие баланс между ростом, дифференцировкой и гибелью клеток [7]. Точно так же многие внутриклеточные патогены, включая бактерии и вирусы, производят специфические белки, которые «переплетают» эндогенные сигнальные пути [7]. 8–10]. Многие белки бактериальных патогенов, которые взаимодействуют с клеточной сигнальной киназой и путями регуляции актина, часто для подавления иммунного ответа хозяина или усиления инфекции (см. Дополнительную вставку 1).Таким образом, используя синтетическую биологию для понимания пластичности путей и того, как их поведение изменяется из-за сетевых возмущений, мы можем получить лучшую основу для понимания стратегий, которые патоген принимает для использования внутренней уязвимости сигнальных сетей. Более того, мы можем разработать стратегии для возврата больной сети к стабильному, непатологическому поведению. Наиболее стабильные методы лечения на основе сети могут включать не просто блокировку первичного онкогенного белка лекарством, а изменение структуры сети таким образом, чтобы она располагалась в новой и стабильной области поведенческого пространства.
Применение инженерной передачи сигналов в терапии и биотехнологии
Еще одним мотивом для разработки сигнального поведения клеток является возможность конструирования клеток, запрограммированных для выполнения точно разработанных приложений (). Представьте себе, если бы мы могли имитировать и превзойти эволюцию, используя набор молекулярных компонентов для генетической инженерии клеток, которые выполняют индивидуально разработанные реакции. По мере развития биологии стволовых клеток [11–12] и развития таких методов, как адоптивная иммунотерапия [13–14], возможность использования клеточной терапии становится все ближе, но это потребует сложной клеточной инженерии для точного контроля поведения клеток.Например, без нового контроля, как может быть направлена правильная миграция и дифференцировка стволовых клеток для регенеративной медицины при отсутствии нормальных сигналов развития? Более того, по мере того, как все больше промышленных производственных процессов задействуют биологические организмы (такие как производство биотоплива или материалов) [15], может появиться возможность разработать более разумные производственные штаммы, которые, как и макроскопические производственные объекты, будут иметь системы клеточного контроля, которые отслеживают внешние и внутренние состояния для оптимизации производство.Это может быть особенно важно, поскольку мы просим ферментирующие организмы, такие как дрожжи, производить широкий спектр материалов, которые могут оказывать токсическое действие.
Разработанные противораковые клетки
Если мы сосредоточимся на разработке индивидуальных терапевтических клеток, которые могут воспринимать сигналы болезни и выполнять целенаправленные и точно откалиброванные терапевтические программы, какое поведение мы хотели бы? Иммунные клетки, такие как Т-лимфоциты или естественные клетки-киллеры, можно модифицировать для идентификации и уничтожения опухолевых клеток.Такие клетки уже можно удалить у пациентов, генетически модифицировать, размножить ex vivo и адаптивно перенести обратно пациенту [16-17]. Противораковая клетка может быть разработана для обнаружения комбинации сигналов, связанных с опухолью, включая специфические опухолевые антигены, гипоксию, органоспецифические антигены, а также специфические факторы роста и цитокины, которые секретируются опухолями, чтобы избежать нормальных иммунных ответов и создать микроокружение, способствующее развитию опухолей [18],. Инженерные клетки, которые распознают эти факторы, но связаны с противоопухолевым ответом, были бы идеальными.Также критически важно разработать внешний контроль (например, небольшую молекулу) или предохранительные переключатели для этих терапевтических клеток, чтобы их поведение можно было отключить или ослабить в ответ на нежелательные побочные эффекты, или чтобы титровать величину их реакции.
Сконструированные клетки, которые обнаруживают эти специфические для опухоли входные данные, могут быть сконструированы для получения ряда различных ответов, таких как производство агентов визуализации, которые помогают в идентификации опухолей и метастазов, и контроль эндогенных иммунных клеточных реакций, таких как хемотаксис, фагоцитоз и убийство клеток.Возможно, наиболее важно то, что эти терапевтические клетки могут быть запрограммированы на секретирование факторов, нарушающих локальное микроокружение опухоли, таких как провоспалительные цитокины и факторы антиангиогенеза, что делает их непригодными для устойчивого роста опухоли. Это было бы эквивалентно созданию специальной иммунной клетки, которая выводит из строя опухолевые клетки и микроокружение на нескольких уровнях.
Направленная иммуносупрессия
Иммунная клетка также может быть разработана для блокирования аутоиммунного заболевания или отторжения трансплантированных органов.Обычная иммуносупрессивная лекарственная терапия имеет широкие и серьезные системные эффекты. Сконструированная клетка может быть запрограммирована на местную иммуносупрессивную реакцию, возможно, в ответ на специфические аутоиммунные антигены или антигены трансплантата в сочетании с цитокиновыми сигнатурами сильного аутоиммунного ответа. Такие клетки могут быть запрограммированы на хемотаксис к участкам этих сигналов и реагировать путем секреции противовоспалительных цитокинов, которые отключили бы воспалительные петли положительной обратной связи, которые обычно приводили бы к полномасштабной аутоиммунной реакции или реакции отторжения.
Хотя индивидуально разработанные терапевтические клетки — это будущее, полезно подумать о том, какое поведение обнаружения и реакции будет ценным, так как они обеспечивают полезные целевые вехи в разработке инструментов и стратегий для перестройки клеток.
Можно ли проектировать сети передачи сигналов сотовой связи?
Существуют большие разногласия относительно того, действительно ли элементы можно спроектировать. Системы клеточной сигнализации настолько тонко оптимизированы, что наше вмешательство приведет к катастрофическим сбоям, или настолько надежно спроектированы эволюцией, что добавление новых генов и сетевых связей не сможет существенно изменить функцию? Очевидно, что эволюция смогла перестроить клеточные сигнальные пути, чтобы получить разнообразные ответы — на определенном уровне они относительно пластичны и эволюционируют.Таким образом, прежде чем пытаться создать новое клеточное поведение, может быть поучительно подумать о том, как эволюция может достичь инновационных новых функций.
Отличительной чертой сигнальных белков, которая, как полагают, играет важную роль в эволюции, является их модульная структура. Они почти всегда состоят из множества модульных доменов, некоторые из которых выполняют каталитическую функцию, а многие — специфические регуляторные функции или функции взаимодействия [19, 20]. Эти модульные домены встречаются в различных сигнальных белках в самых разных комбинациях.Это привело к модели, согласно которой разнообразие сигнальных функций может развиваться посредством рекомбинации этого набора доменов. Таким образом, в принципе, если бы мы могли понять, как эволюция работает с этими модулями, мы могли бы использовать тот же набор инструментов, чтобы найти области пространства поведения, которые эволюция, насколько нам известно, еще не исследовала.
Почему сигнальные белки и системы настолько модульны? Большинство согласны с тем, что в эволюционной временной шкале организмы находятся под давлением приспособленности к развитию инновационных клеточных сигнальных реакций, которые могут привести к преимуществам в изменяющейся окружающей среде и по сравнению с конкурирующими организмами.Под воздействием такого рода изменяющегося давления приспособленности модульные системы могут спонтанно развиваться как способ облегчить более быструю диверсификацию функций [21]. Алон и его сотрудники смоделировали эволюцию биологической сети, используя эволюционные алгоритмы для поиска простых вычислительных сетей, которые решают поставленную цель [22]. Когда они неоднократно меняют целевую цель, результирующие сети спонтанно развивают более модульные решения — сети, которые имеют внутри себя функциональные подсети. Эти заранее сформированные подсети — модули — могут быть быстро переподключены новыми способами для перехода от одной целевой функции к другой.По сути, кажется, что модули предоставляют способ быстро перемещаться из одного функционального пространства в другое, перепрыгивая через обширные области нефункционального сетевого пространства. Таким образом, модульная организация сигнальных белков и сетей может отражать давление на эти системы с целью создания поведения, которое соответствует потребностям постоянно меняющейся среды.
Важность модульности в облегчении эволюции новых функций согласуется с концепциями эволюции и развития, в которых утверждается, что большая часть диверсификации функций и морфологии организмов эволюционирует через альтернативное регулирование существующих компонентов, а не на изобретение принципиально новых компонентов [23].Хотя многие из этих идей были разработаны с упором в первую очередь на регуляцию генов с помощью различных цис-действующих модулей, они также могут применяться к регуляции ключевых каталитических сигнальных модулей с помощью разнообразных локализационных и регуляторных модулей [24,25]. Неудивительно, что многие из усилий по разработке нового сигнального поведения, описанного ниже, используют стратегии рекомбинации модульных функциональных единиц новыми способами, таким образом, по сути, используя эволюционную стратегию для создания новой функции.
Разработка новых сенсорных систем
Одним из наиболее важных инструментов для изменения поведения клеток будет способность создавать новые датчики и рецепторы для целевых входов.Однако это, пожалуй, наименее охарактеризованный элемент в инженерии клеточной сигнализации, потому что вселенная возможных входов настолько обширна и часто включает проблему работы с относительно сложными мембранно-ассоциированными мембранными белками. Ниже мы описываем недавний прогресс в модификации или конструировании различных рецепторных молекул.
Перенаправление выхода естественных рецепторов
Природные рецепторы, которые обнаруживают специфические эндогенные входы, могут быть спроектированы для генерации неродной выходной реакции.Есть несколько примеров перенаправления нативного рецептора, чтобы вызвать новый транскрипционный ответ. Один из таких подходов использует модульную структуру рецепторного белка Notch. Notch — это трансмембранный рецептор, который обнаруживает белок Delta, присутствующий на соседних клетках, — критический канал межклеточной коммуникации в развитии и дифференцировке. Когда Delta связывает Notch, трансмембранная область Notch расщепляется мембранной протеазой, высвобождая C-концевой домен Notch в цитоплазму.Этот домен может проникать в ядро и активировать транскрипцию гена. Struhl et al. Показали, что этот модуль фактора транскрипции рецептора notch может быть заменен синтетическим фактором транскрипции (Gal4-AD), так что при активации in vivo этот химерный рецептор notch может активировать гены, нацеленные на новый фактор транскрипции [26 , 27]. Хотя эту конструкцию использовали в качестве репортера для активации Notch, ее можно было легко использовать для связывания обнаружения нативного дельта-лиганда с совершенно новым набором ненативных генов-мишеней.
Barnea et al. Расширили эту модульную стратегию, вдохновленную Notch, путем создания новых транскрипционных выходов для других рецепторов, которые обычно не используют этот тип механизма активации протеаз [28]. Когда рецепторы, сопряженные с G-белком (GPCR), активируются своими специфическими лигандами, они часто рекрутируют β-аррестин, который участвует в подавлении передачи сигналов GPCR. Barnea et al. Слили аррестин с высокоспецифичной протеазой вируса травления табака (TEV), так что он был совместно задействован в активированных GPCR.Синтетический фактор транскрипции также был слит с цитоплазматическим хвостом GPCR, связанным сайтом расщепления TEV. Таким образом, когда сконструированный слитый белок GPCR активируется своим эндогенным лигандом, он рекрутирует партнера протеазы аррестин-TEV, который расщепляет и высвобождает домен фактора транскрипции из GPCR, посредством чего он может проникать в нуклеазу и активировать гены-мишени. Эта система успешно использовалась для связывания новых репортеров транскрипции с активацией широкого спектра специфических GPCR.Ответ очень специфичен благодаря специфичности расщепления TEV. В принципе, эту стратегию можно использовать для связывания любого эндогенного сигнала, опосредованного GPCR, с экспрессией желаемых генов-мишеней.
Barnea et al. Также использовали эту стратегию для связывания передачи сигналов эндогенной рецепторной тирозинкиназы (RTK) с новыми выходами транскрипции [28]. Большинство RTK при стимуляции активируют свои киназные домены, которые опосредуют аутофосфорилирование цитоплазматических тирозинов для рекрутирования белков, содержащих домен Sh3.Здесь протеаза TEV была слита с рекрутированными доменами Sh3, а синтетический фактор транскрипции был слит с цитоплазматическим хвостом RTK через сайт расщепления протеазой TEV. Итак, активация RTK ведет к рекрутированию слияния Sh3-домен-TEV, высвобождению ассоциированного с рецептором фактора транскрипции и транскрипции гена инженерии. Примечательно, что эта простая модульная стратегия может быть применена к нескольким классам рецепторов, если они привлекают определенный белок-партнер при активации.
Howard et al. Использовали модульность передачи сигналов RTK для перенаправления сигнала онкогенного роста на апоптотический ответ [29]. Они сконструировали новый адаптерный белок Sh3, в котором домен Sh3, распознающий активированный RTK, был слит с доменом эффектора смерти от Fadd. Таким образом, активация RTK привела к рекрутированию в мембрану домена смерти, что вызвало ответ клеточной смерти. Возможность увязки других новых результатов с этими ключевыми событиями найма еще недостаточно изучена.
Рецепторы, которые обнаруживают новые входные данные малых молекул
Вышеупомянутые стратегии сосредоточены на способах получения рецепторов, которые обнаруживают эндогенные сигнальные молекулы, и конструируют их так, чтобы вызывать новые ответы. Однако во многих случаях для клеточной инженерии могут потребоваться рецепторы, которые обнаруживают новые сигналы, для которых нет эндогенных рецепторов. Эти новые сигналы включают в себя небольшие молекулы, которые мы можем захотеть обеспечить внешнее управление инженерной системой.
Относительно хорошие успехи были достигнуты в использовании GPCR в качестве платформы для конструирования контролируемых рецепторов на малых молекулах.Некоторые GPCR, такие как опиоидные рецепторы, могут активироваться их эндогенными лигандами и специфическими низкомолекулярными агонистами. Конклин, Рот и его сотрудники сконструировали молекулы, известные как рецепторы, активируемые исключительно синтетическими лигандами (RASSL) [30,32]. Эти рецепторы мутированы так, что они не могут связывать свой эндогенный лиганд, но активируются и вызывают свой эндогенный нисходящий эффект в ответ на небольшой фармакологически инертный молекулярный агонист.
GPCR различаются по своим выходам, отчасти потому, что отдельные рецепторы связываются со специфическими гетеротримерными G-белками.Дальнейшая разработка дала версии RASSL, которые специфически связаны с каждым из этих отдельных нисходящих путей, тем самым позволяя малым молекулам контролировать очень разнообразный набор выходов. Эти RASSL были успешно применены у трансгенных мышей — по сути, перестраивая передачу сигналов в полноценном живом организме — в основном в качестве диагностического и аналитического инструмента. Применение было разнообразным, учитывая широкое использование GPCR в разных тканях. Например, мыши, несущие вкусовые нейроны, экспрессирующие RASSL, проявляли специфические сладкие (привлекательные) или горькие (аверсивные) ответы на воду, смешанную с агонистом (спирадолином), в зависимости от того, в каком типе нейрона они экспрессировались [33].Кроме того, экспрессия RASSL в клетках сердца позволяет контролировать частоту сердечных сокращений путем введения спирадолина [34]. То, что эти рецепторы in vivo так надежно работают, , намекает на их потенциальную полезность в более сложной клеточной инженерии.
Химические димеризаторы образуют другую стратегию достижения контроля малых молекул над передачей сигналов. Такие стратегии были рассмотрены в другом месте [35,36] и не будут здесь обсуждаться.
Рецепторы, которые обнаруживают определенные пользователем антигены
Было бы идеально разработать рецепторы, которые могут воспринимать ассоциированные с заболеванием антигены, такие как белок, сильно экспрессирующийся в опухоли или инфекционном агенте.Если бы рецепторы могли быть сконструированы для достижения такого же разнообразия и избирательности распознавания, что и антитела, можно было бы обнаруживать широкий спектр входных сигналов и связывать их с конкретными ответами. Химерные антигенные рецепторы (CAR) — рецепторы, созданные с использованием одноцепочечных антител (scFv) как часть механизма их обнаружения, — были разработаны как универсальный каркас этого типа. Эта стратегия проистекает из модульности рецепторов иммунных клеток, таких как рецептор Т-клеток. Хотя Т-клеточный рецептор представляет собой сложный мультибелковый комплекс, сшивания цитоплазматической области субъединицы дзета-цепи CD3 достаточно для индукции передачи сигналов Т-клетками [37].Дзета-цепь CD3 содержит мотивы, которые фосфорилируются при активации тирозинкиназами, такими как Lck, для индукции рекрутирования белков, содержащих домен Sh3, таких как киназа ZAP-70. Слияние цитоплазматической области дзета-цепи CD3 с внеклеточным одноцепочечным антителом (scFv) дает рецептор, часто называемый «Т-тельцем», который при экспрессии в Т-клетках приводит к целенаправленному уничтожению клеток, экспрессирующих узнаваемый антиген (предположительно, поверхностные антигены сшивают и активируют химерные рецепторы) [38,39].Слияние scFv с внутриклеточной областью рецептора Fc (гамма-цепь) может дать химерный антиген-чувствительный рецептор аналогичного типа. Эти исследования подчеркивают модульность этих рецепторов: соединение нового внеклеточного распознающего элемента с нижележащими внутриклеточными сигнальными элементами приводит к новому датчику ввода / вывода.
Эти CAR первого поколения относительно примитивны и дали неоднозначные результаты. Т-клетки, экспрессирующие CAR, направленные против опухолевых антигенов, обладают умеренной сигнальной способностью по сравнению с эндогенными ответами TCR, умеренно пролиферируют ex vivo и in vivo и имеют низкую выживаемость при многократном воздействии антигена [16,17]].Улучшения в этом поведении были сделаны путем включения дополнительных модульных доменов во внутриклеточные области CARs, включая домены от молекул корецепторов, которые являются частью нормальной активации TCR, таким образом, возможно, имитируя более полную активированную внутриклеточную сборку [40,41]. Клетки, содержащие CAR следующего поколения, более эффективно контролируют опухоли ксенотрансплантата у мышей, и в настоящее время переносятся на клинические испытания [16]. Более сложная инженерия CAR может привести к еще большему улучшению терапевтической функции.
Датчики, которые обнаруживают физические сигналы, такие как свет
Еще одна интересная область исследований — разработка генетически закодированных датчиков, которые могут обнаруживать свет и преобразовывать его в конкретный биологический ответ, область, называемая оптогенетикой. Встречающиеся в природе светочувствительные белки растений, водорослей и бактерий можно модифицировать для использования в высших организмах, включая млекопитающих. Эти инструменты чрезвычайно полезны в качестве пространственно-временных шкал для контроля и анализа сложного клеточного и организменного поведения, особенно когда они экспрессируются с помощью промоторов, специфичных для клеточного типа.В долгосрочной перспективе оптогенетические инструменты могут использоваться для удаленного контроля клеток, используемых в терапевтических целях, хотя существуют серьезные технические проблемы, такие как то, как свет может доставляться в организм, которые необходимо будет преодолеть. Наиболее часто используемые сегодня оптогенетические инструменты — это белки микробного канала родопсин и галородопсин, которые широко используются для контроля функции нейронов. Они рассмотрены в другом месте [42] и не будут здесь подробно обсуждаться.
Совсем недавно появились дополнительные оптогенетические инструменты, которые могут быть применены к более широкому спектру клеточных сигнальных систем.Airan et al. Сконструировали набор активируемых светом GPCRs, которые могут связываться как с нижележащими Gs, так и с гетеротримерными G-белками Gq [43]. Были созданы химеры светочувствительной зрительной системы GPCR, родопсин (бычий), которые содержат внутриклеточные петли от Gq- и Gs-сопряженных адренергических рецепторов. Эндогенная молекула сетчатки — это светочувствительный хромофор. Эти новые инструменты значительно расширяют «словарь» передачи сигналов, которым можно управлять с помощью света, учитывая важность путей передачи сигналов Gq и Gs в различных типах клеток.
Еще более обобщенная стратегия управления светом включает использование контролируемых светом белковых взаимодействий. Временное взаимодействие конкретных белков-партнеров является основой многих внутриклеточных сигнальных событий (см. Ниже), и рецепторы могут быть обойдены, так что свет напрямую контролирует такие внутриклеточные взаимодействия. Левская и др. Использовали систему взаимодействия фитохрома, полученную из растений — связывание этого фоторецептора с его партнерским доменом PIF может включаться и выключаться с помощью определенных длин волн света — для рекрутирования определенных белков на мембрану точным пространственно-временным образом [44].В случае факторов обмена гуаниновых нуклеотидов (GEF), которые контролируют GTPases семейства Rho, это может быть использовано для запуска активации GTPase и последующих изменений цитоскелета, приводящих к световодному выпячиванию клеток. Хотя этот метод является мощным и потенциально применимым ко многим сигнальным взаимодействиям, система Phy-PIF требует добавления проницаемого для клетки хромофора, который не является эндогенным для клеток млекопитающих. Wu et al. Использовали светочувствительный домен LOV (свет-кислород-напряжение) (обнаруженный в растениях, водорослях и бактериях) для конформационной закупорки Rac GTPase контролируемым светом способом [45].Этот связывающий флавин домен обеспечивает еще один потенциально общий конформационный элемент управления светом, который может быть связан для управления различными сигнальными белками.
Инженерные системы обработки сигналов
В конечном итоге клетки решают, какие программы ответа выполнять на основе внутриклеточных сигнальных сетей, которые принимают и обрабатывают сигналы от сенсорных молекул (см. Выше). Недавняя работа в области сотовой инженерии была сосредоточена на понимании того, как эти сети функционируют для принятия решений и как их можно изменить.
Модульная логика обработки сигналов
Внутриклеточные сигнальные белки имеют высокую модульность (см. Выше). Большинство модулей делятся на два класса (). Первый класс — это ферментные домены, такие как киназы и фосфатазы, которые катализируют посттрансляционные модификации или конформационные изменения, с помощью которых сохраняется информация. В большинстве случаев эти каталитические домены входят в пары: ферменты-писатели (например, киназы) производят модификацию, а ферменты-стиратели (например, фосфатазы) удаляют модификацию.Второй класс — это регуляторные домены или домены взаимодействия, которые модулируют активность каталитических доменов или нацеливают их на конкретных партнеров или сайты в клетке. Эти модули могут опосредовать специфические белок-белковые взаимодействия (либо конститутивные взаимодействия, либо те, которые зависят от посттрансляционных модификаций, таких как фосфорилирование) или белок-мембранные взаимодействия. Таким образом, именно регуляторные домены и домены взаимодействия определяют, когда и где активируются каталитические домены и каким партнерам они передают информацию [5].
Модульная логика компонентов внутриклеточной сигнализацииa | ферментных и регуляторных доменов . Модульные сигнальные белки эукариот обычно состоят из ферментативных доменов и доменов локализации. Ферментные домены, такие как киназы и фосфатазы, а также GEF и GAP, катализируют регуляторные модификации, такие как фосфорилирование и активация GTPase, соответственно (ферментные домены часто входят в пары «писатель» и «стиратель», которые имеют противоположные активности).Эти ферментные домены регулируются и нацелены на домены взаимодействия, включая домены межбелкового взаимодействия, домены мембранного взаимодействия или трансмембранные домены.
b | различных классов многодоменных архитектур . Ферментативные домены могут быть непосредственно нацелены на определенные субстраты, партнеров или субклеточные участки посредством доменов взаимодействия. В качестве альтернативы они могут быть косвенно нацелены через адаптеры или белки каркаса, которые содержат несколько доменов взаимодействия.Домены взаимодействия могут также аллостерически регулировать каталитические домены, участвуя во внутримолекулярных аутоингибиторных взаимодействиях. Такие переключающие белки могут быть активированы конкурирующими лигандами, которые снимают аутоингибирование.
Эти разные классы модулей обнаруживаются в различных комбинациях и расположениях в сигнальных белках (). Каталитические домены, слитые с нацеливающими доменами, могут быть задействованы в определенных комплексах или участках мембраны, где они будут модифицировать определенные мишени; часто эти каталитические домены имеют высокую внутреннюю константу Михаэлиса (Km’s и, следовательно, требуют нацеливания с помощью дополнительных доменов взаимодействия для эффективного катализа.Иногда эти нацеленные взаимодействия регулируются, если, например, взаимодействие зависит от посттрансляционной модификации, такой как нацеливание белков домена Sh3 на аутофосфорилированные сайты pTyr на активированных RTK. Белки с двумя доменами взаимодействия могут действовать как адаптеры, которые переводят одно взаимодействие во второе, что приводит к увеличению гибкости ответа в зависимости от адаптерных белков, которые экспрессируются в конкретном типе клеток. Белки с множественными доменами взаимодействия могут также функционировать как скаффолдные белки, которые организуют несколько белков на пути в комплекс.Эти взаимодействия могут быть конститутивными или предопределенными, или индуцированными такими факторами, как фосфорилирование или конформационные изменения, которые открывают сайты взаимодействия. Таким образом, каркасные белки могут в принципе определять проводные связи сигнальных белков, а также контролировать, когда и где происходит передача сигналов [24, 20].
Вторая важная роль взаимодействия и регуляторных доменов — это непосредственный контроль активности каталитических доменов. Во многих случаях домены взаимодействия участвуют во внутримолекулярных аутоингибиторных взаимодействиях, которые стерически закрывают каталитический домен или конформационно возмущают его — тип регуляции, называемый модульной аллостерией [46].Связывание конкурирующих межмолекулярных лигандов с доменами взаимодействия индуцирует каталитическую активность белков. Часто множественные домены взаимодействия участвуют в автоингибировании каталитического домена кооперативным или иерархическим образом [47, 48]. Эти белки могут функционировать как сложные переключатели с множеством входов, которые требуют определенной комбинации входов для правильной активации. Кроме того, поскольку внешние лиганды активируют эти белки, локализация (управляемая этими взаимодействиями) может быть напрямую связана с активацией.
Разработка новых белковых переключателей
Лим и его сотрудники исследовали, можно ли использовать модульную аллостерическую логику многих природных эукариотических сигнальных белков для создания новых сигнальных переключателей путем рекомбинации доменов (). В самом деле, каталитические домены актинового регуляторного белка N-WASP и GEF семейства Rho могут быть связаны с новыми аутоингибиторными доменами с образованием белков, активность которых регулируется новыми лигандами [49,50]. Внутримолекулярное связывание любого из этих каталитических доменов с доменом PDZ и пептидом лиганда PDZ может давать переключатель, который активируется конкурирующим пептидом PDZ.Точно так же можно добавить несколько доменов взаимодействия, чтобы получить комбинаторный переключатель, отображающий управление логическим элементом И. В зависимости от точной конфигурации доменов и внутримолекулярных взаимодействий типы регуляции могут быть разными в ответ на разные конкурирующие внешние лиганды — один лиганд может активировать белок, а другой репрессировать его. Эти типы разнообразных взаимоотношений между регуляторными доменами напоминают разнообразное поведение, наблюдаемое в природных сигнальных белках, подтверждая представление о том, что этот вид архитектуры переключения облегчает эволюцию разнообразных комбинаторных регуляторных переключателей [48].Dueber et al. Также показали, что синтетические аутоингибирующие переключатели, использующие поливалентные взаимодействия одного и того же типа, приводят к переключениям, поведение активации которых может быть настроено кооперативно от линейного до цифрового ответа [51].
Инженерные схемы обработки сигналовa | инженерных переключателей аллостерических белков . Dueber et al [49,51] показали, что аллостерическая регуляция сигнального белка N-WASP может быть перепрограммирована путем рекомбинации каталитического домена из N-WASP с различными комбинациями доменов взаимодействия.Новые модели поведения включали управление с множеством входов (логический элемент И) и активную активацию, подобную переключателю.
b | с использованием белков каркаса в качестве молекулярной печатной платы для преобразования выходных сигналов . Связь входа / выхода киназного пути MAP в дрожжах может быть перенаправлена через сконструированный химерный каркас, который собирает новую комбинацию киназ [58]. Новые сайты взаимодействия также могут быть добавлены к каркасам для привлечения дополнительных модулирующих факторов.Эти дополнительные факторы могут быть построены синтетическими петлями обратной связи, которые могут быть использованы для создания путей, которые отображают разнообразную динамику передачи сигналов [62].
Каркасные белки как молекулярные схемы
Цепи внутриклеточной передачи сигналов также можно напрямую контролировать, используя регуляторные взаимодействия для перепрограммирования соединений путей. Например, каталитический домен киназы семейства Src, Hck, который обычно регулируется доменами Sh3 и Sh4, может быть слит с доменом PDZ и направлен in vivo для специфического фосфорилирования субстратов с мотивом лиганда PDZ [52].
Белки каркаса также могут быть использованы для создания новых взаимосвязей между входом и выходом пути. У дрожжей существует множество функционально различных киназных путей митоген-активированного протеина (MAP), которые регулируют ответы на феромон спаривания и осмотический стресс [53,54]. Эти пути имеют общие компоненты киназ, но остаются специфическими, потому что каждый путь организован отдельным каркасным белком [55–57]. Химерный каркасный белок, который организует избранных членов путей спаривания и осмотического стресса, дает неприродный путь, в котором феромон спаривания специфически индуцирует программу реакции осмостресса в vivo [58].Подобные ковалентные слияния, которые, подобно каркасу, вызывают взаимодействие между двумя сигнальными белками, могут быть использованы для принудительной передачи сигнала по единственному пути [59].
Совсем недавно было показано, что каркасные белки не только опосредуют линейные отношения ввода / вывода путей, но также координируют набор модуляторных факторов, которые формируют дозовую зависимость и динамику ответа пути [60,61]. Вдохновленный этими природными примерами, Башор и др. Показали, что дрожжевой скаффолд MAP-киназы, белок Ste5, можно использовать в качестве молекулярной печатной платы, чтобы гибко изменять количественное поведение реакции спаривания [62].Слияние дополнительного сайта синтетического взаимодействия с каркасом Ste5 (с использованием пары гетеродимеров лейциновой застежки) способствует привлечению новых модулирующих факторов, таких как фосфатаза MAPK, которая подавляет ответ пути. Однако, если экспрессия и рекрутирование фосфатазы связаны с выходным сигналом пути, возникает петля отрицательной обратной связи, которая приводит к адаптации — временный ответ, за которым следует автоматический возврат к более низким уровням выхода, что является ключевым поведением во многих биологических сенсорных системах.Связывая по-разному положительные и отрицательные модуляторы пути, этот небольшой набор элементов управления каркасом может быть использован для генерации очень разнообразных дозовых реакций и динамического поведения, включая высоко кооперативное переключение, отложенные ответы, ускоренные ответы и генерацию импульсов. Эти исследования показывают, как организующие центры, такие как каркас, являются богатой платформой для обработки и формирования внутриклеточной передачи сигналов посредством эволюции или инженерии.
Инженерная пространственная самоорганизация
Один из наиболее плохо изученных аспектов передачи сигналов в клетке — это то, как контуры, состоящие из диффундирующих молекул, могут приводить к высокоточной пространственной организации в клетке, такой как направленная поляризация и миграция.Этот тип самоорганизации является аспектом схемы управления, где нет хороших электронных или инженерных аналогов, и где биология может обучать инженерии.
Инженерные принципы применяются для понимания механизма поляризации почкующихся дрожжей, S. cerevisae . Поляризация контролируется GTPase Cdc42, которая в конечном итоге локализуется в одном сайте материнской клетки, приводя к образованию единственной почки, которая врастает в дочернюю клетку [63].Примечательно, что этот процесс приводит к образованию единственной бутоны почти со 100% надежностью. Цепь положительной обратной связи с участием Cdc42 GTPase является ключевой в поляризации: активный Cdc42 на мембране рекрутирует цитоплазматический белок GEF Bem1, который активирует и локализует дополнительный Cdc42 [64]. Хотя этот вид петли обратной связи ведет к образованию фокусов Cdc42, быстрая диффузия и перераспределение Bem1 между конкурирующими фокусами может быть важным, чтобы позволить одному из фокусов стать доминирующим, что ведет к сингулярности почкования.Эффект замедления диффузии и перераспределения Bem1 за счет связывания его с трансмембранным мотивом был проанализирован [65]. Bem1, привязанный к мембране, может спасти летальность от нокаута Bem1, но не может подвергаться диффузии в цитоплазме. Вместо этого он доставлялся к плазматической мембране в везикулах через актиновые кабели (также координируемые фокусами Cdc42) и от мембранных фокусов посредством эндоцитоза и, таким образом, перераспределялся намного медленнее. Наблюдались серьезные дефекты сингулярности, такие как множество устойчивых конкурирующих фокусов Cdc42, и частота многопочкованных клеток увеличивалась до ~ 5%.Подобные исследования помогают выявить требования к точно контролируемой пространственной самоорганизации и предполагают, что мы можем научиться создавать сигнальные цепи, которые производят индивидуальные пространственные результаты с важным терапевтическим поведением (например, регенеративная медицина, которая требует определенной клеточной морфологии и ориентации).
Создание предсказуемой инженерии передачи сигналов
Исследования, приведенные выше, показывают, что сигнальные системы являются высокомодульными и пластичными и рекомбинирующие модули, особенно каталитические домены с новыми регуляторными доменами, могут приводить к отличному ответному поведению.Таким образом, вопрос уже не в том, можно ли спроектировать сигнальные системы для получения нового поведения, а в том, можно ли их спроектировать таким образом, чтобы мы могли предсказать, какое поведение проявится и насколько успешной будет каждая спроектированная схема.
Проблема непредвиденных перекрестных помех
Одна из основных проблем, связанных с передачей сигналов инженерной клетки, заключается в том, что естественные компоненты — инструментарий доступных доменов — повторно используются, что может привести к непредвиденным перекрестным помехам. Приведут ли инженерные взаимодействия, которые вы создаете, к специфическому фосфорилированию желаемого белка, или используемый домен также будет перекрестно взаимодействовать с другими мишенями, конкурентно титруя важные физиологические взаимодействия и приводя к непредвиденным эффектам или сбоям в спроектированной схеме? Часто природные части не обладают абсолютной специфичностью, и эволюция, скорее всего, использует сложные сети перекрестной реактивности, чтобы обеспечить важную скоординированную регуляцию.Хотя такая сложная система, похожая на нейронную сеть, может обеспечить преимущества для клетки, это проклятие для прогнозной инженерии.
Представляя будущий инструментарий сигнализации
Одним из решений этой проблемы является сборка инструментария из деталей, специально оптимизированных для проектирования. Этот вопрос важен для любого типа сигнальной части, но мы сосредоточимся на том, как собрать полезный инструментарий из частей, взаимодействующих с белками ().
Улучшение инструментария для предсказуемой инженерии клеточной сигнализации: части ортогонального взаимодействияНативная клетка имеет свой собственный репетитор модулей взаимодействия с белками, и поэтому сложно разработать новые функции с использованием связанных модулей взаимодействия, которые могут показывать непреднамеренные и непреднамеренные перекрестные помехи в камере.Оптимизированный набор взаимодействующих частей может значительно повысить предсказуемость клеточной инженерии, исключив возможность непреднамеренных перекрестных помех. Несколько стратегий оптимизации включают разработку модулей взаимодействия, которые используют неиспользованную специфичность; разработка составных, многодоменных взаимодействий; объединение модулей взаимодействия с новым субклеточным нацеливанием; и импорт модулей ортогонального взаимодействия (либо созданных синтетически, либо из других организмов), которых нет в клетке-хозяине.
Хотя природа неоднократно использовала семейства частей, такие как домены взаимодействия определенного типа, недавние исследования показывают, что в некоторых случаях члены семейства содержат неиспользуемые сайты узнавания внутри этих доменов. Их можно использовать для создания пар домен-пептид, которые одновременно оптимизированы для взаимодействия со своим правильным партнером, избегая при этом перекрестного взаимодействия с другими членами семейства [66,67]. Фактически были сконструированы пары PDZ-домен-лиганд и гетеродимеризующиеся пары лейциновой застежки-молнии, которые оптимизированы, чтобы избежать перекрестной реакции с естественными доменами того же типа [68,69].Избирательность и предсказуемость существующих доменов взаимодействия также можно улучшить путем разработки составных взаимодействий. Конечно, многодоменное сотрудничество — естественный механизм повышения специфичности. Но новый поворот в этом вопросе — это разработка составных двухкомпонентных взаимодействий типа «раскладушка». Koide et al. Взяли домен PDZ и слили его с доменом фибронектина [70]. Используя фаговый дисплей, они отобрали варианты этого тандемного домена, которые связывают определенный пептид, так что он находится между двумя доменами.Резко увеличенная площадь распознавания приводит к взаимодействиям с гораздо более высокой специфичностью и сродством. Другое решение для специфичности, которое наблюдается в природе, — это дифференциальная компартментализация. Если нацеливающие мотивы могут быть использованы для локализации партнерских белков в определенных органеллах или клеточных участках, то мотивы взаимодействия, вероятно, будут функционировать более специфическим образом, особенно если в этом месте или органелле происходит мало или совсем не происходит конкурирующих взаимодействий этого типа.
Альтернативный подход к достижению надежной специфичности заключается в импорте доменов из других организмов, которых нет в создаваемом хозяине. Напр., PDZ домены могут быть импортированы в дрожжи (у которых отсутствует большинство таких доменов), хотя возможность случайных перекрестных реагирующих партнеров не может быть исключена [58]. Примером ортогональной молекулярной системы, которая была успешно перенесена на нового хозяина, является бактериальная рекомбиназная система Cre-Lox, которая надежно используется для создания сложных хромосомных перестроек в сложных организмах, включая мышей [71].
Таким образом, представляя инструментарий будущего, можно захотеть создать набор из десяти или около того пар взаимодействия белков, оптимизированных для конкретного выбранного организма (например, E.coli , S.cerevisae , млекопитающие) в том, что они ортогональны, то есть известно, что они не реагируют перекрестно с протеомом хозяина или белками в наборе инструментов, за исключением их родственного лиганда. Также важно, чтобы эти взаимодействия были настраиваемыми, поэтому серия лигандов для каждого домена взаимодействия, которые различаются по аффинности на несколько порядков, были бы идеальными.Это позволило бы систематически исследовать, как сродство вербовки меняет поведение системы.
Комбинаторный дизайн и прогнозирование
Другой другой, но все же дополнительный подход к предсказуемому проектированию передачи сигналов соты состоит в использовании комбинаторной изменчивости. В ходе естественной эволюции рекомбинация сигнальных модулей для генерации новой функции, по-видимому, не была спроектирована или направлена, а скорее была относительно случайной, и именно естественный отбор выявил события перепрограммирования, которые привели к преимуществам приспособленности.Таким образом, очень плодотворным подходом, учитывая отсутствие предсказуемости в клеточной инженерии, могло бы быть построение комбинаторных библиотек синтетических схем и выбор желаемой функции [25,72]. Более того, этот подход можно было бы комбинировать с полу- прогнозное проектирование, при котором могут быть разработаны общие архитектуры спроектированных схем, но комбинаторные методы используются для поиска в более широком диапазоне пространства параметров (с использованием вариантов каждого модуля в библиотеке). Сосредоточение внимания на комбинаторном выборе может также обеспечить очень полезную стратегию на заре синтетической биологии, поскольку это может помочь нам быстрее узнать о основных принципах проектирования.
Outlook
Цель понимания того, как клетки общаются и принимают решения, остается очень привлекательной, особенно потому, что понимание молекулярного языка внутри клетки может позволить нам общаться с клетками и инструктировать их выполнять новые запрограммированные функции. Наша способность перестраивать клеточную сигнализацию может обеспечить множество мощных приложений, таких как терапевтические клетки, запрограммированные на обнаружение селективного набора сигналов, связанных с заболеванием, и на локальный ответ точно настроенным образом.
Хотя эволюция достигла такого рода инноваций и точной инженерии клеточных функций, мы только начинаем понимать, как достичь такого рода цели. У нас есть хорошее фундаментальное понимание логики клеточных сигнальных механизмов и источников функциональной пластичности. Кроме того, были сделаны первые важные шаги в разработке новых рецепторно-сенсорных систем, а также новых или модифицированных схем обработки внутриклеточных сигналов. Несмотря на эти инструменты, на сегодняшний день было приложено очень мало усилий для того, чтобы связать эти типы компонентов новыми способами, чтобы получить более крупные интегральные схемы, способные давать очень точные и точные отклики.Такие усилия продолжаются. Например, Cell Propulsion Lab — это наномедицинский центр Национального института здравоохранения (http://nihroadmap.nih.gov/nanomedicine/devcenters/cellularcontrol.asp), который пытается использовать относительно простые противоопухолевые иммунные клетки, созданные с использованием синтетических рецепторов химерных антигенов ( CAR), и улучшают обработку их сигналов и набор ответов, которые они вызывают, чтобы оптимизировать клетки для экспансии ex vivo, , in vivo, выживания, противоопухолевой цитотоксичности и нарушения благоприятного микроокружения опухоли.Будет интересно увидеть, как будут развиваться эти типы усилий и как эти проблемы повысят сложность и надежность сотовой инженерии.
Новейшие инженерные датчики сигнализацииa | перенаправление собственных входов на новые выходы . С-концевой домен рецептора notch представляет собой фактор транскрипции, который высвобождается в результате трансмембранного протеолиза при активации лигандом дельта. Замена альтернативным доменом фактора транскрипции дает новый ответ экспрессии гена [26].Выход рецептора, сопряженного с G-белком (GPCR), может быть перенаправлен аналогичным образом путем слияния домена фактора транскрипции через привязку с сайтом протеазы TEV. Активация GPCR приводит к привлечению белка аррестина. Если в клетке экспрессируется слияние протеазы аррестин-TEV, активация GPCR приводит к высвобождению фактора транскрипции и новому выходу экспрессии гена [28]. Таким образом, активация GPCR может быть произвольно связана с новым транскрипционным выходом. Выход рецепторной тирозинкиназы (RTK) может быть перенаправлен за счет привлечения синтетических адаптеров домена Sh3 или PTB к активированному и фосфорилированному тирозин рецептору.Домен Sh3 может быть использован для рекрутирования протеазы TEV (чтобы снова высвободить искусственно связанный транскрипционный домен) [28] или для рекрутирования новых эффекторных доменов, таких как те, которые участвуют в гибели клеток [29].
b | инженерный новаторский контроль ввода для собственных ответов . GPCR были сконструированы так, чтобы их контролировали низкомолекулярные агонисты путем мутации их внеклеточной поверхности, так что они больше не связывают свои эндогенные лиганды (рецепторы, активируемые исключительно синтетическим лигандом — RASSL [32]).Рецепторы, которые активируют Т-клетки в ответ на произвольные входные данные, могут быть созданы путем слияния сконструированных одноцепочечных антител (scFv) с внутриклеточной областью Т-клеточного рецептора (дзета-цепь CD3), которые называются рецепторами химерных антигенов (CARs [16, 17]). Событие передачи сигнала, опосредованное рекрутингом, может быть помещено под световой контроль путем замены эндогенного взаимодействия на светозащитное взаимодействие, пара взаимодействий Phytochrome-PIF от растений [44].
Инженерно-пространственное регулированиеa | Цепь поляризации дикого типа контролирует образование одиночных почек. В почкующихся дрожжах локализованная активация полярности GTPase Cdc42 усиливается петлей положительной обратной связи — активный Cdc42 рекрутирует каркасный белок Bem1, совместно собирает активированную p21 киназу (PAK — Ste20) и Cdc42 GEF (Cdc24). Хотя клетка может иметь несколько фокусов Cdc42, они быстро распадаются на один доминантный фокус, который развивается только в клетки. Предполагается, что быстрая скорость обмена диффундирующим комплексом Bem1 / PAK / GEF между конкурирующими фокусами Cdc42 является критической для разделения в один доминантный фокус.
b | синтетическая цепь медленной поляризации приводит к образованию множественных бутонов . Чтобы проверить эту гипотезу, Bem1 был искусственно привязан к мембране через слитый мотив нацеливания на мембрану [65]. Хотя этот связанный с мембраной Bem1 может должным образом собирать комплекс Bem1 / PAK / GEF на участках активности Cdc42 (т.е. петле положительной обратной связи), обмен комплексом между конкурирующими фокусами Cdc42 происходит медленно (зависит от везикулярного транспорта через актиновые кабели и эндоцитоза) .Эта синтетическая поляризационная схема, следовательно, приводит к плохому разрешению конкурирующих фокусов Cdc42 и гораздо более высокой частоте (5% против ~ 0%) многопучковых клеток (микрофотографии из [65]).
Ссылки
2. Киль Ч., Юс Э., Серрано Л. Инженерные пути передачи сигналов. Клетка. 2010. 140 (1): 33–47. [PubMed] [Google Scholar] 3. Sprinzak D, Elowitz MB. Реконструкция генетических цепей. Природа. 2005; 438: 443–8. [PubMed] [Google Scholar] 4. Мукхерджи С., ван Ауденаарден А. Синтетическая биология: понимание биологического дизайна из синтетических цепей.Nat Rev Genet. 2009; 10: 859–71. [Бесплатная статья PMC] [PubMed] [Google Scholar] 5. Башор CJ, Хорвиц AA, Peisajovich SG, Lim WA. Перепрограммирование клеток: синтетическая биология как инструмент для исследования организационных принципов живых систем. Анну Рев Биофиз. 2010 16 февраля; [Epub перед печатью] [Бесплатная статья PMC] [PubMed] [Google Scholar] 6. Yeh BJ, Lim WA. Синтетическая биология: уроки истории синтетической органической химии. Nat Chem Biol. 2007; 3: 521–5. [PubMed] [Google Scholar] 7. Вайнберг Р. Биология рака.Наука о гирляндах; 2006. [Google Scholar] 9. Мюнтер С., Вэй М., Фришкнехт Ф. Сигнализация во время инфекции патогена. Sci STKE. 2006; 2006: re5. [PubMed] [Google Scholar] 10. Shan L, He P, Sheen J. Перехват сигнальных каскадов MAPK хозяина с помощью бактериальных эффекторов III типа. Клеточный микроб-хозяин. 2007; 1: 167–74. [PubMed] [Google Scholar] 11. Кискинис Э., Эгган К. Прогресс в клиническом применении плюрипотентных стволовых клеток для конкретных пациентов. J Clin Invest. 2010; 120: 51–9. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12.Линдвалл О., Кокая З. Стволовые клетки при нейродегенеративных расстройствах человека — время для клинического перевода? J Clin Invest. 2010; 120: 29–40. [Бесплатная статья PMC] [PubMed] [Google Scholar] 14. Варела-Рохена А., Карпенито С., Перес Э., Ричардсон М., Парри Р., Милон М., Шоллер Дж., Хао Х, Мексас А., Кэрролл Р. Г., Чемпион июня, Райли Дж. Л.. Генная инженерия Т-клеток для адоптивной иммунотерапии. Immunol Res. 2008; 42: 166–81. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Ли С.К., Чжоу Х., Хэм Т.С., Ли Т.С., Кизлинг Д.Д. Метаболическая инженерия микроорганизмов для производства биотоплива: от насекомых до синтетической биологии и топлива.Curr Opin Biotechnol. 2008; 19: 556–63. [PubMed] [Google Scholar] 16. Sadelain M, Brentjens R, Rivière I. Перспективы и потенциальные ловушки химерных антигенных рецепторов. Curr Opin Immunol. 2009; 21: 215–23. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Tlsty TD, Coussens LM. Строма опухоли и регуляция развития рака. Анну Рев Патол. 2006; 1: 119–50. [PubMed] [Google Scholar] 19. Поусон Т., Нэш П. Сборка клеточных регуляторных систем через домены взаимодействия белков. Наука. 2003; 300: 445–52.[PubMed] [Google Scholar] 20. Бхаттачарья Р.П., Ременьи А., Йе Б.Дж., Лим В.А. Домены, мотивы и каркасы: роль модульных взаимодействий в эволюции и подключении сигнальных цепей клетки. Анну Рев Биохим. 2006; 75: 655–80. [PubMed] [Google Scholar] 23. Кэрролл С.Б. Эво-дево и расширяющийся эволюционный синтез: генетическая теория морфологической эволюции. Клетка. 2008. 134: 25–36. [PubMed] [Google Scholar] 24. Скотт Дж. Д., Поусон Т. Передача сигналов в клетках в пространстве и времени: где белки объединяются, а когда разделяются.Наука. 2009; 326: 1220–4. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Пейсайович С., Гарбарино Дж., Вей П., Лим В.А. Быстрая диверсификация сигнальных фенотипов клеток за счет рекомбинации модульных доменов. Наука. в прессе. [Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Struhl G, Adachi A. Ядерный доступ и действие notch in vivo. Клетка. 1998. 93: 649–60. [PubMed] [Google Scholar] 27. Спринзак Д., Лакханпал А., ЛеБон Л., Сантат Л.А., Фонтес М.Э., Андерсон Г.А., Гарсия-Охалво Дж., Эловиц МБ. Цис-взаимодействия между Notch и Delta создают взаимоисключающие сигнальные состояния.Природа. в прессе. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Barnea G, Strapps W, Herrada G, Berman Y, Ong J, Kloss B, Axel R, Lee KJ. Генетический дизайн сигнальных каскадов для регистрации активации рецепторов. Proc Natl Acad Sci USA. 2008; 105: 64–9. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Howard PL, Chia MC, Del Rizzo S, Liu FF, Pawson T. Перенаправление передачи сигналов тирозинкиназы на путь апоптоза каспазы через химерные адаптерные белки. Proc Natl Acad Sci U S. A. 2003; 100: 11267–72.[Бесплатная статья PMC] [PubMed] [Google Scholar] 30. Conklin BR, Hsiao EC, Claeysen S, Dumuis A, Srinivasan S, Forsayeth JR, Guettier JM, Chang WC, Pei Y, McCarthy KD, Nissenson RA, Wess J, Bockaert J, Roth BL. Разработка сигнальных путей GPCR с помощью RASSL. Нат методы. 2008; 5: 673–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31. Армбрустер Б.Н., Ли Х, Пауш М.Х., Херлитце С., Рот Б.Л. Доработка замка для соответствия ключу для создания семейства рецепторов, связанных с G-белком, активно активируемых инертным лигандом.Proc Natl Acad Sci U S. A. 2007; 104: 5163–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 32. Трус П., Вада Х.Г., Фальк М.С., Чан С.Д., Мэн Ф., Акил Х., Конклин Б.Р. Управление передачей сигналов с помощью специально разработанного Gi-связанного рецептора. Proc Natl Acad Sci U S. A. 1998; 95: 352–7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 33. Zhao GQ, Zhang Y, Hoon MA, Chandrashekar J, Erlenbach I., Ryba NJ, Zuker CS. Рецепторы сладкого вкуса и вкуса умами млекопитающих. Клетка. 2003. 115: 255–66. [PubMed] [Google Scholar] 34. Redfern CH, Coward P, Дегтярев М.Ю., Lee EK, Kwa AT, Hennighausen L, Bujard H, Fishman GI, Conklin BR.Условная экспрессия и передача сигналов специально сконструированного Gi-сопряженного рецептора у трансгенных мышей. Nat Biotechnol. 1999; 17: 165–9. [PubMed] [Google Scholar] 35. Корсон Т.В., Аберли Н., Экипаж СМ. Дизайн и применение бифункциональных малых молекул: почему две головы лучше, чем одна. ACS Chem Biol. 2008; 3: 677–692. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Поллок Р., Клэксон Т. Экспрессия гена, регулируемая димеризером. Curr Opin Biotechnol. 2002; 13: 459–67. [PubMed] [Google Scholar] 37. Ирвинг Б.А., Вайс А.Цитоплазматического домена дзета-цепи Т-клеточного рецептора достаточно для соединения с рецептор-ассоциированными путями передачи сигнала. Клетка. 1991; 64: 891–901. [PubMed] [Google Scholar] 38. Гросс Г., Горохов Г., Вакс Т., Эшхар З. Создание эффекторных Т-клеток, экспрессирующих химерный Т-клеточный рецептор со специфичностью типа антитела. Transplant Proc. 1989; 21: 127–30. [PubMed] [Google Scholar] 39. Eshhar Z, Waks T, Bendavid A, Schindler DG. Функциональная экспрессия генов химерных рецепторов в Т-клетках человека. J Immunol Methods.2001; 248: 67–76. [PubMed] [Google Scholar] 40. Maher J, Brentjens RJ, Gunset G, Rivière I, Sadelain M. Цитотоксичность и пролиферация Т-лимфоцитов человека, управляемые одним химерным рецептором TCRzeta / CD28. Nat Biotechnol. 2002; 20: 70–5. [PubMed] [Google Scholar] 41. Карпенито К., Милоне М.К., Хассан Р., Симонет Дж. К., Лакхал М., Сухоски М. М., Варела-Рохена А., Хейнс К. М., Хейтджан Д. Ф., Альбельда С. М., Кэрролл Р. Г., Райли Дж. Л., Пастан I, Джун Чемпион. Контроль крупных установленных ксенотрансплантатов опухолей с генетически перенаправленными человеческими Т-клетками, содержащими домены CD28 и CD137.Proc Natl Acad Sci U S. A. 2009; 106: 3360–5. [Бесплатная статья PMC] [PubMed] [Google Scholar] 42. Чжан Ф., Араванис А.М., Адамантидис А., де Лесеа Л., Дейссерот К. Автоматические выключатели: оптические технологии для исследования нейронных сигналов и систем. Nat Rev Neurosci. 2007; 8: 577–81. [PubMed] [Google Scholar] 43. Airan RD, Thompson KR, Fenno LE, Bernstein H, Deisseroth K. Временный контроль внутриклеточной передачи сигналов in vivo. Природа. 2009; 458: 1025–9. [PubMed] [Google Scholar] 44. Левская А, Вайнер О.Д., Лим В.А., Фойгт CA.Пространственно-временной контроль клеточной передачи сигналов с использованием переключаемого светом белкового взаимодействия. Природа. 2009; 461: 997–1001. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Wu YI, Frey D, Lungu OI, Jaehrig A, Schlichting I., Kuhlman B, Hahn KM. Генетически кодируемый фотоактивируемый Rac контролирует подвижность живых клеток. Природа. 2009; 461: 104–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 46. Lim WA. Модульная логика сигнальных белков: построение аллостерических переключателей из простых связывающих доменов. Curr Opin Struct Biol.2002; 12: 61–8. [PubMed] [Google Scholar] 47. Prehoda KE, Scott JA, Mullins RD, Lim WA. Интеграция нескольких сигналов посредством совместной регуляции комплекса N-WASP-Arp2 / 3. Наука. 2000; 290: 801–6. [PubMed] [Google Scholar] 48. Ю Б., Мартинс И.Р., Ли П., Амарасинге Г.К., Уметани Дж., Фернандес-Запико М.Э., Билладо Д.Д., Мачиус М., Томчик Д.Р., Розен М.К. Структурные и энергетические механизмы кооперативного аутоингибирования и активации Vav1. Клетка. 2010. 140: 246–56. [Бесплатная статья PMC] [PubMed] [Google Scholar] 49.Dueber JE, Yeh BJ, Chak K, Lim WA. Перепрограммирование управления переключателем аллостерической сигнализации посредством модульной рекомбинации. Наука. 2003; 301: 1904–8. [PubMed] [Google Scholar] 50. Йе Би Джей, Рутильяно Р. Дж., Деб А., Бар-Саги Д., Лим ВА. Перестройка путей клеточной морфологии с помощью факторов обмена синтетических гуаниновых нуклеотидов. Природа. 2007. 447: 596–600. [PubMed] [Google Scholar] 51. Дуэбер Дж. Э., Мирский Е. А., Лим В. А.. Разработка синтетических сигнальных белков со сверхчувствительным управлением вводом / выводом. Nat Biotechnol.2007; 25: 660–2. [PubMed] [Google Scholar] 52. Ядав С.С., Йе Б.Дж., Крэддок Б.П., Лим В.А., Миллер В.Т. Реинжиниринг сигнальных свойств киназы семейства Src. Биохимия. 2009. 48: 10956–62. [Бесплатная статья PMC] [PubMed] [Google Scholar] 53. Гаррингтон Т.П., Джонсон Г.Л. Организация и регуляция сигнальных путей митоген-активируемой протеинкиназы. Curr Opin Cell Biol. 1999; 11: 211–8. [PubMed] [Google Scholar] 54. Шварц М.А., Мадхани HD. Принципы специфичности передачи сигналов MAP-киназы у Saccharomyces cerevisiae.Анну Рев Жене. 2004. 38: 725–48. [PubMed] [Google Scholar] 55. Чой К.Ю., Саттерберг Б., Лион DM, Элион Э.А. Ste5 связывает несколько протеинкиназ в каскаде MAP-киназ, необходимых для спаривания у S. cerevisiae. Клетка. 1994. 78 (3): 499–512. [PubMed] [Google Scholar] 56. Printen JA, Sprague GF., Jr. Белковые взаимодействия в пути ответа феромонов дрожжей: Ste5p взаимодействует со всеми членами каскада киназ MAP. Генетика. 1994. 138 (3): 609–19. [Бесплатная статья PMC] [PubMed] [Google Scholar] 57. Посас Ф, Сайто Х.Осмотическая активация пути HOG MAPK через Ste11p MAPKKK: роль каркаса Pbs2p MAPKK. Наука. 1997. 276 (5319): 1702–5. [PubMed] [Google Scholar] 58. Park SH, Zarrinpar A, Lim WA. Перестройка путей MAP-киназы с использованием альтернативных механизмов сборки каркаса. Наука. 2003; 299: 1061–4. [PubMed] [Google Scholar] 59. Харрис К., Ламсон Р.Е., Нельсон Б., Хьюз Т.Р., Мартон М.Дж., Робертс С.Дж., Бун С., Прайчак П.М. Роль каркасов в специфичности пути киназы MAP, выявленная путем индивидуального дизайна сигнальных белков, предназначенных для этого пути.Curr Biol. 2001. 11 (23): 1815–24. [PubMed] [Google Scholar] 60. Dodge-Kafka KL, Soughayer J, Pare GC, Carlisle Michel JJ, Langeberg LK, Kapiloff MS, Scott JD. Заякоренный белок mAKAP протеинкиназы А координирует два интегрированных эффекторных пути цАМФ. Природа. 2005. 437 (7058): 574–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 61. Мишра П., Соколич М., Уолл М.А., Грейвс Дж., Ван З., Ранганатан Р. Динамическое формирование каркаса в системе передачи сигналов, связанной с G-белком. Клетка. 2007. 131 (1): 80–92. [PubMed] [Google Scholar] 62.Башор CJ, Helman NC, Yan S, Lim WA. Использование инженерных взаимодействий каркаса для изменения динамики передачи сигналов пути киназы MAP. Наука. 2008. 319 (5869): 1539–43. [PubMed] [Google Scholar] 63. Чант Дж. Полярность клеток в дрожжах. Annu Rev Cell Dev Biol. 1999; 15: 365–91. [PubMed] [Google Scholar] 64. Козубовски Л., Сайто К., Джонсон Дж. М., Хауэлл А. С., Зила Т. Р., Лью Д. Д.. Поляризация, нарушающая симметрию, управляемая комплексом Cdc42p GEF-PAK. Curr Biol. 2008. 18 (22): 1719–26. [Бесплатная статья PMC] [PubMed] [Google Scholar] 65. Howell AS, Savage NS, Johnson SA, Bose I, Wagner AW, Zyla TR, Nijhout HF, Reed MC, Goryachev AB, Lew DJ.Необычность в поляризации: перестройка дрожжевых клеток для образования двух бутонов. Клетка. 2009. 139 (4): 731–43. [Бесплатная статья PMC] [PubMed] [Google Scholar] 66. Зарринпар А, Парк SH, Лим WA. Оптимизация специфичности в сети взаимодействия белков клетки путем отрицательного отбора. Природа. 2003. 426 (6967): 676–80. [PubMed] [Google Scholar] 67. Stiffler MA, Chen JR, Grantcharova VP, Lei Y, Fuchs D, Allen JE, Zaslavskaia LA, MacBeath G. Селективность связывания домена PDZ оптимизирована по протеому мыши. Наука. 2007. 317 (5836): 364–9.[Бесплатная статья PMC] [PubMed] [Google Scholar] 68. Эрнст А., Сазинский С.Л., Хуэй С., Каррелл Б., Дхарси М., Сешагири С., Бадер Г.Д., Сидху С.С. Быстрая эволюция функциональной сложности в семействе доменов. Sci Signal. 2009; 2 (87): ра50. [PubMed] [Google Scholar] 69. Григорян Г., Рейнке А.В., Китинг А.Е. Дизайн специфичности взаимодействия с белками дает селективные bZIP-связывающие пептиды. Природа. 2009. 458 (7240): 859–64. [Бесплатная статья PMC] [PubMed] [Google Scholar] 70. Хуанг Дж., Коиде А., Макабе К., Коиде С. Дизайн скачков функции белка путем направленной эволюции интерфейса домена.Proc Natl Acad Sci U S. A. 2008; 105 (18): 6578–83. [Бесплатная статья PMC] [PubMed] [Google Scholar] 71. Зауэр Б. Индуцируемое нацеливание гена у мышей с использованием системы Cre / lox. Методы. 1998. 14 (4): 381–92. [PubMed] [Google Scholar]Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки вашего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Длина и временные масштабы сигнальных цепей клетка-клетка в агаре
Abstract
Сообщество генетически гетерогенных клеток, встроенных в несмешанную среду, позволяет выполнять сложные операции, сохраняя пространственную дифференциацию и координируя разделение труда.Чтобы установить принципы создания надежной связи между ячейками в гетерогенной среде, мы исследовали, как параметры схемы и пространственное размещение влияют на диапазон длин и временных масштабов, в которых взаимодействуют простые схемы связи. Мы сконструировали несколько штаммов «отправитель» и «получатель» с сигнальными цепями, определяющими кворум. Колония клеток-отправителей продуцирует ацилгомосериновые лактоны (AHL), которые диффундируют через полутвердую среду. Колония клеток-приемников обнаруживает эти сигнальные молекулы и сообщает о них по флуоресценции.Мы обнаружили, что одной колонии с одним вариантом отправителя достаточно, чтобы вызвать отклик получателя на расстоянии более 1,5 см. Кроме того, экспрессия деградазы AHL в принимающих колониях вызывает пороговый эффект сигнала и снижает уровень ответа в последующих принимающих колониях. Наконец, наше исследование пространственного размещения колоний привело к созданию многоклеточного массива дальней связи, состоящего из двух чередующихся типов колоний. Его сигнальный ответ успешно распространялся от колонии к колонии вдоль массива из шести колоний, охватывающего 4 человека.8 см при скорости передачи 12,8 часа на колонию или 0,075 см в час. Кроме того, мы разработали модель реакции-диффузии, которая воссоздает наблюдаемое поведение многих выполненных экспериментов с использованием оценок параметров диффузии сигнала, экспрессии генов и потребления питательных веществ на основе данных. Эти результаты демонстрируют, что смешанное сообщество колоний может дать возможность новым программам формирования паттернов, а соответствующая модель будет способствовать рациональному проектированию сложных коммуникационных сетей.
Введение
Исследования в области синтетической биологии включают определение эффективных алгоритмов и стратегий в живых системах и применение этих знаний в искусственном биологическом дизайне. Этот подход оказался успешным для небольших генетических цепей в однородных культурах, таких как логические сети и генераторы в бактериях [9, 17], но для выполнения более сложных задач потребуются продвинутые стратегии.
Одной из новых стратегий является микробный консорциум, создание множества генетически различных штаммов взаимодействующих микробов для достижения желаемой функции [5, 15].Смешанное сообщество сконструированных клеток может выполнять более сложные функции, чем гомогенная популяция, потому что разделение сложного пути между генетически различными, кооперативными популяциями облегчает торговлю устойчивостью-сложностью, связанную с синтетическими генными цепями [3, 16]. Нельзя недооценивать важность координации для микробных сообществ. От метаболических отношений разделения труда до условно-патогенных микроорганизмов человека, которые одновременно атакуют скомпрометированные ткани [12, 13], почти все микробы координируются внутри вида и между границами видов.Таким образом, установление принципов разработки надежного скоординированного поведения является важным шагом на пути к более продвинутым приложениям синтетической биологии.
Недавние исследования описали сконструированные синтетические консорциумы, способные к ряду скоординированных действий, таких как экологическая динамика [18], популяционная динамика [16] и формирование паттернов [3, 4, 7, 11]. В некоторых из этих работ к препаратам полутвердых сред были применены множественные штаммы микробов [3]. Пространственная неоднородность этих сред позволила обнаруживать полосу поведения [3] и могла позволить другие новые взаимодействия и сети формирования паттернов.Однако диапазон возможного расстояния и времени передачи данных в полутвердых средах явно не исследовался. Эта информация поможет обрисовать диапазон паттернов поведения, которые можно получить экспериментально с помощью простых взаимодействий и координации, обеспечивая основу для будущих исследований более сложных программ паттернов.
Здесь мы стремились исследовать инженерные принципы надежной связи между ячейками в гетерогенных средах сантиметрового масштаба.Мы исследовали, как параметры схемы и пространственное размещение влияют на диапазон длин и временных масштабов, в которых простые коммуникационные схемы взаимодействуют в полутвердой среде. Эти сигнальные цепи используют компоненты контроля кворума (QS) для программирования напряжений «отправителя» и «получателя» (рис. 1). Колония клеток-отправителей продуцирует сигнальные молекулы ацилгомосеринлактон (AHL), которые диффундируют через полутвердую среду. Колония клеток-приемников обнаруживает сигналы AHL и сообщает о них по флуоресценции. Мы настроили радиус передачи сигналов, максимальное расстояние, отделяющее колонию-отправитель от колонии-получателя, с которой она может связываться, путем изменения силы сайта связывания рибосомы (RBS) как в цепи отправителя, так и в цепи получателя.Мы обнаружили, что одной колонии с одним вариантом штамма-отправителя достаточно, чтобы вызвать ответ приемника на расстоянии более 1,5 см. Кроме того, мы продемонстрировали, что экспрессия деградазы AHL в принимающих колониях вызывает пороговый эффект сигнала и снижает уровень ответа в последующих принимающих колониях.
Рисунок 1:Пример собранной пары сигнальных цепей отправитель-приемник. В клетке-отправителе синтаза CinI продуцирует один тип сигнала AHL, который диффундирует через агар.В клетке-приемнике AHL связывает CinR с образованием комплекса, который активирует экспрессию GFP.
Основываясь на парадигме отправитель-получатель, мы стремились достичь более длинных расстояний передачи сигналов путем создания каскада связи, в котором AHL, излучаемый колониями-отправителями, инициирует передачу сигналов от соседних колоний-отправителей. Мы предусмотрели соединение отдельных колоний в сети связи, состоящей из двух ортогональных химических каналов, основанных на пространственной близости и разделении. Тамсир и др.ранее продемонстрировали аналогичную систему на основе колоний, которая была «подключена» к межклеточной связи на основе QS [19]. Однако относительная пространственная ориентация их колоний не имеет отношения к функции устройства, поскольку каналы связи различаются исключительно ортогональными химическими сигналами, а не пространственным разделением. В нашей работе мы демонстрируем систему, в которой намеренный пространственный образец имеет решающее значение для функционирования системы. Эта система состоит из массива из двух чередующихся типов колоний для связи на большие расстояния (рис. 2).Каждая колония в этой системе взаимодействует с соседней колонией для распространения сигнала колонии за колонией. Следовательно, для этого массива из шести колоний требуются только два ортогональных химических канала. Эта результирующая структура «проводки» может быть расширена до более крупных сигнальных сетей и схем в будущей работе.
Рисунок 2:Сигнальный массив состоит из двух чередующихся деформаций, так что обнаруженный и отправленный сигнал ортогонален в каждой колонии.
Rhl AHL: N-бутирил-L-гомосерин-лактон (C 4 -HSL)
Cin AHL: N- (3-оксотетрадеканоил) -L-гомосерин-лактон (3-Oxo-C14-HSL)
Результаты
Цепь связи с датчиком кворума обеспечивает диапазон полезного расстояния отклика в полутвердых средах
Сначала мы охарактеризовали диапазон расстояния и времени отклика, которые могут быть достигнуты нашими схемами связи QS, путем тестирования различных схем двух вариантов деформации отправителя и четырех вариантов деформации приемника в Чашки с агаром Luria Bertani (LB).Три штамма-приемника были трансформированы цепями, которые различались только силой RBS (рис. 3) перед репортером зеленого флуоресцентного белка (GFP) и фактором транскрипции QS. Сравнение этих штаммов-получателей продемонстрировало, что обмен RBS значительно изменил радиус передачи сигнала ответа, как показано на фиг. 3. В этом эксперименте ряд колоний-отправителей с сильным вариантом RBS был засеян над строками колоний-получателей. Использование слабого RBS перед фактором транскрипции заметно увеличивало базальный уровень GFP и уменьшало ответ цепи.Эффект был достаточно значительным, чтобы сделать этот вариант бесполезным. С другой стороны, альтернативные RBS перед маркером GFP могут существенно повлиять на радиус передачи сигналов.
Чтобы проверить осуществимость сети связи на основе колонии, мы затем продемонстрировали, что отдельная колония-отправитель с сильным или слабым RBS, контролирующим производство синтазы, была способна генерировать ответы в полезных масштабах (рис. 4). В частности, одной колонии сильного отправителя было достаточно, чтобы вызвать ответ более чем на 1 в колонии сильного штамма-получателя.Расстояние 5 см. Это наблюдение показало, что связь между колонией в масштабе длины, необходимой для проектирования сети, возможна.
Рисунок 3:Эффекты сайтов связывания рибосом разной силы. Сильный: B0034, средний: B0032, слабый: B0033 [10] A . B0034 GFP, B0033 CinR B . B0032 GFP, B0034 CinR C . B0034 GFP, B0034 CinR
Рис. 4:Колонии-получатели, отвечающие (GFP) на колонии с одним отправителем. На каждом изображении колония-отправитель была замечена между тремя линиями ячеек-получателей.
Приемник A: B0032 GFP, B0034 CinR
Приемник B: B0034 GFP, B0033 CinR
Приемник C: B0034 GFP, B0033 CinR, B0034 Колонки AiiA
Ухудшение состояния приемника в AHL пороговый эффект сигнала и задержка времени ответа
Мы также создали репортерные штаммы, которые конститутивно экспрессировали AHL-деградазу (AiiA) вместе с репортерной цепью. Колонии этого штамма начинают проявлять измеримую флуоресценцию в более поздний момент времени, чем сопоставимый приемник без экспрессии AiiA (рис. 5).Индукционная кривая колоний, экспрессирующих AiiA, характеризовалась начальным периодом без сигнального ответа, а затем следовало замедленное увеличение, сравнимое с таковым для обычных колоний-получателей (фиг. 6). Мы предполагаем, что экспрессия AiiA первоначально устраняет большую часть AHL до тех пор, пока не будет получено достаточное количество сигналов для насыщения ферментативной способности AiiA. Таким образом, экспрессия AiiA порогового уровня AHL и приводит к задержке ответа сигнала.
Рисунок 5:Задержка флуоресцентного ответа в принимающих клетках, которые продуцируют деградазу (справа в каждой паре), по сравнению с принимающими клетками без деградазы (слева в каждой паре).На этих кадрах изображения показаны четыре блока агара (обведены серыми пунктирными линиями) вышеуказанного макета. Позиции колоний-отправителей заштрихованы серым цветом.
Рисунок 6:Измеренная флуоресценция, усредненная по площади колонии. Измерения начинали после инкубации засеянных планшетов в течение ночи. Приемник, экспрессирующий AiiA, начал проявлять измеримую флуоресценцию в более поздний момент времени.
Приемные колонии, экспрессирующие AHL-деградазу, снижают сигнальный ответ в заблокированных приемных колониях.
Экспрессия AiiA в приемных колониях может влиять на сигнальный ответ в соседних колониях за счет снижения уровня AHL в окружающей области среды.Мы обнаружили, что соседние колонии были затронуты только в определенных ориентациях. Регулярные колонии-получатели оказались незатронутыми при размещении рядом с колониями, экспрессирующими AiiA, на том же расстоянии от ряда клеток-отправителей. Это было верно для колоний, обнаруженных на расстоянии одного шага (2,25 мм от центра к центру) от колоний, продуцирующих деградазу (рис. 7). Однако, когда ряд колоний, продуцирующих AiiA, был помещен между рядом колоний-отправителей и линиями обычных колоний-получателей, расстояние вызова было уменьшено в обычных колониях-получателях (рис. 8).
Рисунок 7:Отклик флуоресценции в обычных колониях-приемниках (слева в каждой паре) был постоянным в зависимости от близости к колониям, продуцирующим деградазу (справа в каждой паре). Этот рисунок представляет собой увеличенную версию рисунка 5 и соответствует той же экспериментальной схеме.
Рисунок 8:Колонии, продуцирующие деградазу (верхний ряд на правом изображении), снижали сигнальный ответ в последующих колониях-приемниках (отмечены по диагонали). Колонии-отправители (не показаны) были отмечены линией над положением колоний, продуцирующих деградазу.
Гетерогенный массив колоний распространяет сигналы AHL для связи на большие расстояния.
Мы исследовали более сложные консорциумы, в которых штаммы продуцируют и реагируют на молекулы AHL из двух ортогональных систем QS. Шаблон схемы, применяемый для создания этих штаммов консорциума, был таким, что присутствие AHL из одной системы QS приводило к продукции синтазы, соответствующей другой системе QS. На рисунке 2 изображена экспериментальная демонстрация, которую мы преследовали для этого консорциума.
Набор состоял из двух штаммов, занимающих чередующиеся позиции колоний вдоль линии. Один из штаммов экспрессировал синтазу Rh1 AHL при обнаружении Cin AHL, тогда как другой штамм экспрессировал синтазу Cin AHL при обнаружении AHL Rhl. Каждая колония в этой системе связывалась с соседней колонией другого типа для распространения сигнала. Всего в тестовой матрице было шесть колоний, и первая колония была индуцирована внешним добавлением Cin AHL. В нашем эксперименте массив колоний с межцентровым расстоянием 9.55 мм успешно продемонстрировали предложенное распространение сигнала от колонии к колонии (Рисунок 9).
Рисунок 9:Массив колоний засевали в день 0 и инкубировали при 37 ° Covernight. Сигнальная цепь была инициирована добавлением 25 мкл Cin AHL к первой колонии в правом нижнем углу массива в день 1 около 11 часов утра. Зеленые колонии экспрессируют GFP и Rh1 AHL-синтазу при обнаружении Cin AHL, в то время как красные колонии экспрессируют RFP и Cin AHL-синтазу при обнаружении Rh1 AHL.
Рисунок 10:Массив колоний с 3.Расстояние между центрами 18 мм на 4-й день. Формирование внутриклеточной петли положительной обратной связи между двумя типами колоний вызывало самоактивацию массива без внешней индукции первой колонии.
Мы протестировали несколько условий управления параллельно, чтобы убедиться, что коммуникационный массив ведет себя через задуманный нами механизм. Одна из серьезных проблем заключалась в возможности формирования петли положительной обратной связи между соседними колониями разных штаммов, приводящей к самоактивации коммуникационного массива.Мы наблюдали это явление, когда два типа колоний находились в физическом контакте (рис. 10). В этом случае массив колоний полностью ответил без внешней индукции первой колонии. Однако эта самоактивация не наблюдалась в коммуникационном массиве с расстоянием 9,55 мм (рис. 11). Его неиндуцированная контрольная матрица флуоресцирует только на фоновом уровне через четыре дня. Кроме того, два дополнительных контрольных набора показали, что сигнал преимущественно распространялся между соседними колониями.Когда одна колония любого типа отсутствовала в массиве, ответ на сигнал значительно уменьшился за пределами этого промежутка (Рисунок 11). Эти результаты подтвердили, что конкретное размещение колонии было решающим для распространения сигнала и что сигнал распространялся от колонии к колонии.
Рисунок 11:Массив колоний с расстоянием между центрами 9,55 мм на 4-й день. Неиндуцированный контрольный массив флуоресцирует только на уровне фона. (верхнее правое изображение) Когда вторая (нижнее левое изображение) или третья (нижнее правое изображение) колония отсутствовала в массиве, ответ на сигнал значительно уменьшился за пределами этого промежутка.
Гетерогенный массив колоний передает сигнальный ответ с постоянной скоростью
Анализ изображения подтвердил и количественно оценил последовательный сигнальный ответ, наблюдаемый в массиве из шести колоний, описанном в предыдущем разделе. Значения флуоресценции нормализовали и усредняли по площади колоний, обнаруженной в определенные моменты времени. На рис. 12 показаны результирующие средние значения флуоресценции во времени для каждой из шести колоний. Эти профили отклика напоминают индукционные кривые.Ответ предположительно инициировался, когда достаточный уровень сигналов AHL впервые достиг колонии, затем ответ линейно увеличивался с уровнем AHL, пока не достиг максимальной индукции, после чего значения флуоресценции стабилизировались.
Эти профили также четко отображают различия во времени начала ответа среди множества колоний. На рисунке 13 время отклика приблизительно равно времени флуоресценции колонии на 25% от максимального уровня, достигнутого в соответствующем канале.Все колонии вошли в индуцируемый диапазон профиля ответа при этом пороге. На рисунке 14 показано, что время отклика линейно увеличивается с числом колоний и что сигнал передается с постоянной скоростью 12,8 часа на колонию или 0,075 см в час.
Рисунок 12:Средняя нормализованная флуоресценция во времени для каждой из шести колоний. Подгоняемые кривые представляют собой полиномы 5-го порядка. Ответ сигнала распространяется от колонии 1 к колонии 6, что соответствует слева направо на этом рисунке. См. Рисунок 2 для построения массива колоний.
Рисунок 13:Сравнение аппроксимированных кривых средней нормированной флуоресценции во времени. Сигнальный ответ распространяется от колоний 1 до 6. См. Рисунок 2 для построения массива колоний.
Рисунок 14:Время, когда отдельные колонии флуоресцируют на 25% от максимального уровня, достигнутого в соответствующем канале.
Рисунок 15:Разрыв в профиле ответа колонии 1. Колония 1 была первой колонией в массиве и его центр был индуцирован внешним добавлением АГЛ. B Область разрыва кривой отклика. C Формирование структуры внутри колоний с течением времени.
В наборе данных очевидно несколько проблем. Во-первых, некоторые временные точки отсутствуют между 40 и 50 часами. Во-вторых, RFP-экспрессирующие колонии, пронумерованные 1, 3 и 5, давали средние значения флуоресценции с большим разбросом и шумом по сравнению с GFP-экспрессирующими колониями, потому что фильм демонстрировал высокочастотную циклическую сдвиг детектируемых значений флуоресценции в канале RFP.Наконец, профиль ответа колонии 1 содержит неожиданную прерывность, выделенную на рисунке 15 B. Неравномерность вызвана обнаружением и прогрессирующим формированием структуры между колониями. В более ранние моменты времени флуоресцирует только центр колонии 1, потому что к центру добавлялась внешняя AHL для инициирования распространения сигнала. Площадь этого флуоресцентного центра определялась и использовалась для нормализации значений флуоресценции. В более поздние моменты времени на краю колонии образовалась кольцевая структура, предположительно из-за обратной связи с соседней колонией (рис. 15 C).Как только структура внешнего кольца полностью сформировалась, для нормализации была обнаружена большая флуоресцентная область, что привело к внезапному снижению средних значений флуоресценции. Мы намереваемся решить эти проблемы в следующей серии экспериментов путем выборки полного набора временных точек, замены RFP на GFP и нормализации значений флуоресценции с использованием областей, обнаруженных на изображениях в ярком поле.
Модель
Благодаря этим экспериментам мы смогли количественно определить длину и временные масштабы коммуникации микробных консорциумов, встроенных в агар.Кроме того, мы разработали модель реакции-диффузии, которая отражает основные особенности, которые мы наблюдали в этих экспериментах. С помощью этой модели мы можем исследовать, как параметры, влияющие на экспрессию белка, рост клеток, восприятие сигнала и выработку сигнала, приводят к сигнальным каскадам. Модель также позволяет нам оценить концентрацию АГЛ как функцию времени и положения, что не может быть рассмотрено непосредственно в эксперименте.
Модель учитывает рост клеток, зависящий от питательных веществ, производство белка, зависимое от питательных веществ, синтез сигнала через синтазные белки, диффузию сигнала, диффузию клеток и диффузию питательных веществ.Поскольку схема относительно проста, мы выбрали для модели дискретное приближение непрерывной системы реакции-диффузии. При такой дискретизации пластина с агаром разделяется на камеры шириной 1 мм, длиной 1 мм и глубиной 5 мм, что соответствует глубине агара в экспериментах. Концентрация модельных видов принимает одно значение в каждом вокселе. Чтобы вычислить дискретизированное приближение диффузии, модель вычисляет скорость изменения концентрации молекул, применяя Первый закон Фикса к поверхностям, разделяющим смежные прямоугольные камеры.Для индексов (i, j) и (x, y) на сетке, определяющей расположение камер на пластине P, и ширину камеры w, вклад диффузии в дискретное приближение пространственной производной вида s принимает следующий вид:
Все остальные уравнения модели используют функции Хилла для моделирования нелинейной ограниченной активности, вызванной малыми молекулами.
В то время как производство белка и рост клеток зависят от наличия питательных веществ, только рост клеток фактически потребляет питательные вещества. Каждая производная от этих видов включает условия производства, которые пропорциональны параметру продукции, наличию питательных веществ в этой камере и концентрации продуцирующих видов (например,грамм. синтаза является продуцентом АГЛ). Доступность питательных веществ является нелинейной функцией локальной концентрации питательных веществ, определяемой функцией Хилла [11].
В то время как производство белка и производство AHL зависят от наличия питательных веществ, только рост клеток фактически потребляет питательные вещества. Эта особенность основана на предположении, что метаболические вложения в составляющие белки цепи незначительны по сравнению со всеми другими клеточными активностями. Кроме того, мы предполагаем, что деградация и диффузия белка незначительны.Это предположение подтверждается наблюдением, что образцы флуоресценции в колонии стабильны на протяжении каждого проведенного эксперимента. Полная система обыкновенных дифференциальных уравнений, определяющих модель, приведена здесь. Более того, модель построена с реалистичными параметрами и единицами для диффузии и концентрации АГЛ, включая время, но мы оставляем единицы, описывающие плотность клеток, количество белка и концентрацию питательных веществ произвольными [11].
Мы выполнили моделирование каждого эксперимента и вручную обнаружили параметры модели (таблица 1, включая начальные значения питательных веществ и плотности), которые дают поведение, подобное тому, которое мы наблюдали в экспериментах.Как и в каждом эксперименте, моделирование позволяет колониям расти в течение смоделированных 18 часов перед добавлением AHL. Ниже представлены первый и последний кадры моделирования эксперимента с полным массивом, описанного выше, первый кадр следует сразу за моделированным добавлением Cin AHL. В установке этого эксперимента два массива были засеяны на одну и ту же пластину, что также имеет место при моделировании. Мы анализируем только массив с большим разделением между колониями.
Смоделированный массив колоний показал постоянную скорость распространения сигнала, как мы обнаружили в эксперименте.Моделирование было также выполнено для проверки того, что распространение сигнала не удается, когда одна колония удаляется из массива, и что массивы с более близко расположенными колониями приводят к неплотной активации сигнальных цепей. Эти результаты моделирования подтверждают, что наша модель схемы действительна и что она позволяет in silico предсказывать более сложные схемы связи или структуры колоний.
Рисунок 16:Начальное и конечное состояния моделирования из моделирования каскадного эксперимента с полным массивом.Нижний ряд графиков показывает маски, которые определяют границы отдельных колоний интересующего сигнального массива и распределение синтазы в этих масках.
Таблица 1:Отобранные вручную параметры модели, которые дают поведение, подобное тому, которое мы наблюдали в экспериментах. Параметры со знаком 0 в их индексе относятся к начальному состоянию моделирования, за 18 часов моделирования до начала эксперимента. C aro , Crao — это начальные значения плотности клеток, применяемые к камерам моделирования, которые соответствуют местоположениям семян колоний. n 0 — начальная концентрация питательных веществ, которая одинакова по всей чашке. Аналогичным образом 2,5 мМ Cin AHL добавляют в камеру для посева колонии 1 после периода роста.
Рисунок 17:В целях определения скорости передачи сигнального каскада, мы рассматриваем значение количества синтазы, чтобы представить флуоресценцию аналогичным образом экспрессируемых репортерных белков в эксперименте. Порог для смоделированных данных был установлен на нормализованное значение флуоресценции колонии, которое Колония 1 принимает через два с половиной часа после воздействия смоделированного болюса AHL, добавленного экспериментатором, но до получения AHL от ближайшего соседа.Скорость передачи при моделировании составляла 0,081 см / час, что немного выше, чем в эксперименте.
Обсуждение
В этом исследовании мы определили несколько методов настройки длины и временных масштабов межклеточной коммуникации в полутвердой среде и применили диапазон взаимодействий к массиву проводящих сигнал колоний. Наши результаты показали, что намеренное расположение колонии может привести к новому взаимодействию и распространению сигнала. Эти свойства могут быть применены для проектирования сложных смешанных сообществ в гетерогенных средах для сложных операций.
Части наших наблюдений и дизайна соответствуют наблюдениям Colisweeper, проекту 2013 ETH Zurich IGEM [1]. Colisweeper — это игра-тральщик с бактериями в агаре. Система состоит из различных колоний, расположенных в виде сот. Отдельные колонии в этой системе используют компоненты QS Luxl-LuxR, чтобы определить, являются ли соседние колонии «минами». Расстояние отклика сигнала было отмечено как 1,5 см в их предварительной характеристике диффузии отправитель-получатель, что попадает в диапазон масштабов длины, определенных в нашей системе Cinl-CinR.Colisweeper применяет это расстояние срабатывания аналогично нашему. Расстояние отклика сообщало разделение колонии на колонию в обеих моделях колоний, чтобы ограничить передачу сигналов за пределы соседних колоний, и, таким образом, обе системы включают намеренное пространственное размещение в конструкции многоклеточных систем.
Наше исследование расширяет предыдущие исследования двумя способами. Во-первых, деградаза AHL обычно используется для отрицательной обратной связи в генетических цепях [8, 9], но здесь мы показали, что экспрессия деградазы AHL может генерировать задержку сигнала и пороговый эффект, а также влиять на клетки в локальной области.Такое поведение расширяет диапазон свойств, которые можно применить к новой системе формирования паттернов. Например, деградаза AHL может стабилизировать выключенное состояние в бистабильной системе положительной обратной связи в полутвердой среде. Во-вторых, мы успешно сконструировали колонии, способные передавать сигнал, в то время как колонии в Colisweeper способны либо излучать сигнал («мины»), либо обнаруживать («не мины») [1]. Эти колонии передатчиков и успешная демонстрация распространения сигнала подтверждают, что можно сформировать более сложную коммуникационную сеть на основе колоний.В такой сети колонии-передатчики могут действовать как сотовые «провода» для соединения колоний с различными функциями, распределенных в определенном пространстве. Примером может служить микробный консорциум, который саморегулирует относительную популяцию неравномерно распределенных подсообществ.
Ограниченная сложность синтетических биологических операций остается центральной проблемой в области синтетической биологии, и для ее решения разрабатываются различные инструменты и методы [14]. Многие потенциальные решения этой проблемы относятся к продвижению ортогональных частей или подсистем, обе из которых улучшают модульность с целью увеличения сложности [2, 6].В этом исследовании мы используем несколько типов клеток и пространственное разделение в гетерогенных средах для достижения разделения. Эти стратегии предоставляют возможность выполнять сложные биологические операции в смешанном сообществе сконструированных клеток, живущих в гетерогенной среде.
Материалы и методы
Конструирование контуров и штаммов
Гены, использованные в этом исследовании, были клонированы системой Golden Gate Assembly [10] с использованием конститутивного промотора (J23106), сайтов связывания рибосом (B0034, B0032, B0033), репортерных кодирующих последовательностей. (GFP, RFP) и терминатор (B0015) из набора CIDAR Moclo Parts Kit [10] и гибридные промоторы QS (pRhlLacO, pCinTetO) и кодирующие последовательности (AiiA, rhll, cinl) от Chen et al [8].
Для сигнальных цепей в исследовании длины и времени, передающие цепи экспрессировали Cinl AHL-синтазу под контролем изопропил-β-D-1-тиогалактопиранозида (IPTG), который был добавлен в чашки с агаром LB. Цепи приемника конститутивно экспрессировали фактор транскрипции CinR и GFP под контролем активированного Cin промотора. Ген конститутивной деградазы AHL (AiiA) был локализован на отдельной плазмиде и котрансформирован вместе с приемной цепью для экспрессирующего деградазу приемного штамма.DH5α-zl и MG1655-zl использовали для штаммов-отправителей, в то время как обычные DH5α и MG1655 использовали для штаммов-получателей.
Каждая сигнальная цепь в коммуникационном массиве состоит из двух генов, которые были клонированы в одну и ту же плазмиду с помощью сборки Гибсона. Одна цепь экспрессирует Rhll и GFP от отдельного активированного Cin промотора, а другая экспрессирует Cin1 и RFP от отдельного активированного Rh1 промотора. Каждая цепь была трансформирована в штамм CY026, который конститутивно экспрессирует факторы транскрипции CinR и RhIR из генома [8].
Покрытие и запись стереоскопа
Пространственные узоры были спланированы в шаблоне Excel в соответствии с сеткой из 1536 пластин. Посевные культуры разводили из разрастаний ночных культур LB до 0,5 или 0,35 OD600. 25 нл жидкой культуры высевали на LB-агар OmniTrays для каждого обозначенного положения с использованием Echo 525 Liquid Handler. Кроме того, в эксперименте с задержкой сигнала, показанном на фиг. 5, полоски агара шириной в 1 лунку между парами колоний физически вырезали и удаляли сразу после посева, чтобы сформировать изолированные блоки агаровой среды для каждой пары колоний.Все засеянные OmniTrays агара LB инкубировали в течение ночи при 37 ° C. 25 нл 2,5 мМ индуктора Cin AHL добавляли к колонии 1 коммуникационного массива на следующее утро с использованием Echo 525 Liquid Handler. После этого чашки с агаром хранили при комнатной температуре. Изображения планшетов получали с помощью микроскопа Olympus MVX10 в каналах RFP и GFP каждые 5–12 часов. Фильмы для подмножества пластинок снимались с 5-минутным интервалом от 12 до 70 часов.
Благодарности
Мы благодарим Андрея Шура за техническую помощь с микроскопом, Шан Хуанга за предоставление E.coli stock и других участников Murray Lab за полезные обсуждения. Джой Дун был поддержан программой Amgen Scholar Program, а Джеймс М. Паркин получил поддержку Института совместных биотехнологий через грант W911NF-09-0001 от Исследовательского управления армии США. Содержание информации не обязательно отражает позицию или политику правительства, и не следует делать вывод об официальном одобрении. Плазмидные векторы и некодирующие области были предоставлены Дугласом Денсмором из лаборатории междисциплинарной интеграции исследовательской лаборатории автоматизации проектирования (Addgene Kit # 1000000059).Промоторы, воспринимающие кворум, кодирующие последовательности и штамм CY026 были предоставлены Мэтью Беннеттом (Addgene Plasmid # 65954, 65952, 72340).
Ссылки
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
JM Callura, CR Cantor и JJ Collins, «Генетический коммутатор для приложений синтетической биологии», Труды Национальной академии наук , т. 109, pp. 5850–5855, 2012.
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
Шоу, С. Рам и Дж. М. Г. Вилар, «Синтетическое сотрудничество в сконструированных популяциях дрожжей», Труды Национальной Академии Наук, том. 104, pp. 1877–1882, 6 февраля 2007 г. 2007.
- ↵
- ↵
- ↵
Genetic Circuit — обзор
23.2.3.2 Oscillator Network
В качестве второго примера, генетическая схема проиллюстрирована реализация генератора. Эта схема называется repressilator и является одной из вех синтетической биологии, появившейся в статье 2000 г. [33].В то время как целью предыдущего примера было описание и повторное использование функции генетической логики, здесь цель состоит в том, чтобы описать инструменты моделирования для разработки сложной схемы с первых шагов. На рисунке 23.3 показана структура схемы. Вкратце, он состоит из трех репрессорных генов и трех репрессируемых промоторов: первый репрессорный белок (LacI) ингибирует транскрипцию второго репрессорного гена (tetR), белковый продукт которого (TetR), в свою очередь, ингибирует экспрессию третьего гена (cI ).Наконец, его белковый продукт (CI) подавляет экспрессию lacI, завершая цикл. Эта отрицательная обратная связь, по существу, вызванная тремя логическими инверторами, приводит к временным колебаниям уровней мРНК и белка.
Рисунок 23.3. Биологическая колебательная сеть. Схема состоит из трех соединенных между собой вентилей НЕ с обратной связью, что позволяет получить кольцевой генератор. Все виды, участвующие в системе (т. Е. Концентрации мРНК и белка), могут колебаться при правильной настройке регуляторных элементов.
Простая модель регуляции транскрипции была использована Elowitz и Leibler [33] для разработки устройства: динамика транскрипции и трансляции может быть выражена как в уравнениях. (23.1) и (23.2), и предполагается, что репрессия промотора следует функции Хилла, как в уравнениях. (23.8) и (23.9).
На ранних этапах разработки репрессилятора основная цель — оценить in silico , может ли такая генетическая конфигурация проявлять колебания своих элементов. По этой причине анализ модели может выполняться на безразмерных уравнениях, используя разумные значения параметров для численного моделирования системы и определения параметров, оказывающих большое влияние на колебательное поведение.Безразмерные уравнения:
(23,22) dmidt = α0i + αi1 + pjni − mi
(23,23) dpidt = βi · (mi − pi)
(i = lacI, tetR, cIj = cI, lacI, tetR)
где m и p — уровни мРНК и белка, пересчитанные на скорость трансляции ( ρ ) и 1/ K , соответственно; α — максимальная активность промотора, а α 0 — его основная активность; время пересчитывается на скорость деградации мРНК; n — коэффициент Хилла; и, наконец, β — это соотношение скорости деградации белка и скорости деградации мРНК.Описанная модель была изучена в симметричной структуре, где количества и параметры ( α , β , α 0 и n ) трех репрессоров идентичны, за исключением специфичности по отношению к их соответствующему промотору.
Включение уравнений транскрипции необходимо для получения колебательного поведения схемы, поскольку колебания могут возникать только тогда, когда производство белка задерживается (например, из-за динамики транскрипции). В противном случае анализ модели показывает, что нет значения параметра, совместимого с автоколебаниями.
Точки равновесия модели ODE можно вычислить, установив производные по времени равными нулю. Поскольку p / α и 1 / (1+ p n ) имеют только одно пересечение, система имеет одну точку равновесия p * , решение p * = α 0+ α / (1+ p * n ). Устойчивость точки равновесия можно изучить, линеаризуя систему уравнений:
(23.24) dδmidt = −δmi − α · n · pjn − 1 (1 + pjn) 2 | p * · δpj
(23,25) dδpidt = β · δmi − β · δpi
, где δ указывает на изменение переменная состояния от точки равновесия p *. Полная линеаризованная система имеет вид:
(23,26) dδydt = A · δy
, где δ y — вектор-столбец переменных состояния линеаризованной системы [ δm 1 δp 1 δm 2 δp 2 δm 3 δp 3 ] T .Из матрицы 6 × 6 A можно исследовать границы устойчивости системы, совместимые с колебаниями, в зависимости от параметров модели. В частности, точка равновесия не должна быть асимптотически устойчивой, чтобы быть совместимой с желаемым колебательным поведением, поэтому по крайней мере одно собственное значение A должно иметь положительную действительную часть. Вкратце, получив собственные значения A , можно найти выражение, которое описывает граничную кривую, разделяющую области, где могут существовать положительные собственные значения действительной части:
(23.27) (β + 1) 2β = 3 · X24 + 2 · X
, где
(23,28) X = −α · n · pn − 1 (1 + pn) 2
Это выражение является функцией всех параметры модели, и это позволяет идентифицировать критические параметры и значения, которые позволяют системе, возможно, показывать колебательное поведение. Все параметры имеют решающее значение для получения точки неустойчивого равновесия (рис. 23.4): требуются высокие значения α , β и n , а также низкое соотношение α 0 / α . .Такие характеристики соответствуют сильным промоторам с низкой основной активностью и высокой кооперативностью, тогда как белки должны иметь высокую скорость распада (для фиксированной скорости распада мРНК). В частности, при β , n и α 0 точка равновесия не может быть нестабильной для значений α ниже определенного порога. Область нестабильности становится больше при увеличении значений n : сравнивая кривые A и B , можно увидеть, что небольшое увеличение (с 2 до 2.1) значения n приводит к гораздо большей нестабильной области, так что скорость распада белка становится менее важной при проектировании колебательного поведения.
Рисунок 23.4. Диаграмма устойчивости модели репрессилятора. Граничные кривые разделяют области, где могут существовать положительные собственные значения действительной части для трех различных конфигураций параметров. A – C соответствуют граничным кривым для различных значений параметров: A, n = 2,1, α 0 = 0; B, n = 2, α 0 = 0; C, n = 2, α 0 / α = 10 −3 .Заштрихованная область соответствует нестабильному участку кривой A.
Источник : Из справ. [33] с разрешения Nature Publishing Group.Это исследование подчеркивает важность математического моделирования в синтетической биологии для поддержки дизайна искусственной функции, поведение которой было нетривиально предсказать как функцию задействованных параметров.
