Атом водорода — Википедия
Атом водорода — физико-химическая система, состоящая из атомного ядра, несущего элементарный положительный электрический заряд, и электрона, несущего элементарный отрицательный электрический заряд. В состав атомного ядра как правило входит протон или протон с одним или несколькими нейтронами, образуя изотопы водорода. Электрон преимущественно находится в тонком концентрическом шаровом слое вокруг атомного ядра, образуя электронную оболочку атома. Наиболее вероятный радиус электронной оболочки атома водорода в стабильном состоянии равен боровскому радиусу a0 = 0,529 Å.
Атом водорода имеет специальное значение в квантовой механике и релятивистской квантовой механике, поскольку для него проблема двух тел имеет точное или приближенное аналитическое решение. Эти решения применимы для разных изотопов водорода, с соответствующей коррекцией.
В квантовой механике атом водорода описывается двухчастичной матрицей плотности или двухчастичной волновой функцией. Также упрощённо рассматривается как электрон в электростатическом поле бесконечно тяжёлого атомного ядра, не участвующего в движении (или просто в кулоновском электростатическом потенциале вида 1/
В 1913 году Нильс Бор предложил модель атома водорода, имеющую множество предположений и упрощений, и вывел из неё спектр излучения водорода. Предположения модели не были полностью правильны, но тем не менее приводили к верным значениям энергетических уровней атома.
Результаты расчётов Бора были подтверждены в 1925—1926 годах строгим квантово-механическим анализом, основанном на уравнении Шрёдингера. Решение уравнения Шрёдингера для электрона в электростатическом поле атомного ядра выводится в аналитической форме. Оно описывает не только уровни энергии электрона и спектр излучения, но и форму атомных орбиталей.
Решение уравнения Шрёдингера для водородного атома использует факт, что кулоновский потенциал является изотропным, то есть не зависит от направления в пространстве, другими словами, обладает сферической симметрией. Хотя конечные волновые функции ( орбитали) не обязательно сферически симметричны, их зависимость от угловой координаты следуют полностью из изотропии основного потенциала: собственные значения оператора Гамильтона можно выбрать в виде собственных состояний оператора углового момента. Это соответствует тому факту, что угловой момент сохраняется при орбитальном движении электрона вокруг ядра. Отсюда следует, что собственные состояния гамильтониана задаются двумя квантовыми числами углового момента l и m (целые числа). Квантовое число углового момента l может принимать значения 0, 1, 2… и определяет величину углового момента. Магнитное квантовое число может принимать m = −l, …, +l; оно определяет проекцию углового момента на (произвольно выбранную) ось
В дополнение к математическим выражениям для волновых функций полного углового момента и проекции углового момента, нужно найти выражение для радиальной зависимости волновой функции. В потенциале 1/r радиальные волновые функции записываются с использованием полиномов Лагерра. Это приводит к третьему квантовому числу, которое называется основным квантовым числом n и может принимать значения 1, 2, 3… Основное квантовое число в атоме водорода связано с полной энергией атома. Заметим, что максимальное значение квантового числа углового момента ограничено основным квантовым числом: оно может изменяться только до n − 1, то есть l = 0, 1, …, n−1.
Из-за сохранения углового момента состояния с одинаковыми l, но различными m в отсутствие магнитного поля имеют одну и ту же энергию (это выполняется для всех задач с аксиальной симметрией). Кроме того, для водородного атома состояния с одинаковыми n, но разными l также вырождены (то есть имеют одинаковую энергию). Однако это свойство — особенность лишь атома водорода (и водородоподобных атомов), оно не выполняется для более сложных атомов, которые имеют (эффективный) потенциал, отличающийся от кулоновского (из-за присутствия внутренних электронов, экранирующих потенциал ядра).
Если мы примем во внимание спин электрона, то появится последнее, четвёртое квантовое число, определяющее состояния атома водорода — проекция углового момента собственного вращения электрона на ось Z. Эта проекция может принимать два значения. Любое собственное состояние электрона в водородном атоме полностью описывается четырьмя квантовыми числами. Согласно обычным правилам квантовой механики, фактическое состояние электрона может быть любой суперпозицией этих состояний. Это объясняет также, почему выбор оси Z для квантования направления вектора углового момента является несущественным: орбиталь для данных l и m′,{\displaystyle m^{\prime },} полученных для другой выделенной оси Z′,{\displaystyle Z^{\prime },} всегда представляется как подходящая суперпозиция различных состояний с разными m (но тем же самым l), которые были получены для Z.
Рассмотрим сейчас решение уравнения Шрёдингера для атома водорода. Так как потенциальная функция электрона в атоме водорода имеет вид U(r)=−e2r,{\displaystyle U(r)=-{\tfrac {e^{2}}{r}},} где e — заряд электрона (и протона), r — радиус-вектор, то уравнение Шрёдингера запишется следующим образом:
- Δψ+2mℏ2(E+e2r)ψ=0.{\displaystyle \Delta \psi +{\frac {2m}{\hbar ^{2}}}\left(E+{\frac {e^{2}}{r}}\right)\psi =0.}
Здесь ψ — волновая функция электрона в системе отсчёта протона, m — масса электрона, ℏ=h3π{\displaystyle \hbar ={h \over 2\pi }} — постоянная Планка, E — полная энергия
электрона, Δ=∂2∂x2+∂2∂y2+∂2∂z2{\displaystyle \Delta ={\frac {\partial ^{2}}{\partial x^{2}}}+{\frac {\partial ^{2}}{\partial y^{2}}}+{\frac {\partial ^{2}}{\partial z^{2}}}} — оператор Лапласа. Так как потенциальная функция зависит от r, а не от координат по отдельности, удобно
будет записать лапласиан в сферической системе координат (r,θ,φ).{\displaystyle (r,\theta ,\varphi ).} В ней он выглядит следующим образом:
- Δψ=1r2∂∂r(r2∂ψ∂r)+1r2sin2θ∂2ψ∂φ2+1r2sinθ∂∂θ(sinθ∂ψ∂θ).{\displaystyle \Delta \psi ={\frac {1}{r^{2}}}{\frac {\partial }{\partial r}}\left(r^{2}{\frac {\partial \psi }{\partial r}}\right)+{\frac {1}{r^{2}\sin ^{2}\theta }}{\frac {\partial ^{2}\psi }{\partial \varphi ^{2}}}+{\frac {1}{r^{2}\sin \theta }}{\frac {\partial }{\partial \theta }}\left(\sin \theta {\frac {\partial \psi }{\partial \theta }}\right).}
Уравнение Шрёдингера в сферических координатах:
- 1r2∂∂r(r2∂ψ∂r)+1r2sin2θ∂2ψ∂φ2+1r2sinθ∂∂θ(sinθ∂ψ∂θ)+2mℏ2(E+e2r)ψ=0.{\displaystyle {\frac {1}{r^{2}}}{\frac {\partial }{\partial r}}\left(r^{2}{\frac {\partial \psi }{\partial r}}\right)+{\frac {1}{r^{2}\sin ^{2}\theta }}{\frac {\partial ^{2}\psi }{\partial \varphi ^{2}}}+{\frac {1}{r^{2}\sin \theta }}{\frac {\partial }{\partial \theta }}\left(\sin \theta {\frac {\partial \psi }{\partial \theta }}\right)+{\frac {2m}{\hbar ^{2}}}\left(E+{\frac {e^{2}}{r}}\right)\psi =0.}
В этом уравнении ψ{\displaystyle \psi } — функция трёх переменных (r,θ,φ).{\displaystyle (r,\theta ,\varphi ).} Разделим его на три более простых уравнения. Для этого представим функцию ψ(r,θ,φ){\displaystyle \psi (r,\theta ,\varphi )} как произведение трёх функций: ψ(r,θ,φ)=R(r)Θ(θ)Φ(φ).{\displaystyle \psi (r,\theta ,\varphi )=R(r)\Theta (\theta )\Phi (\varphi ).} Эти функции будем обозначать просто R,Θ,Φ.{\displaystyle R,\Theta ,\Phi .} Тогда
- ∂ψ∂r=∂R∂rΘΦ, ∂ψ∂θ=∂Θ∂θRΦ, ∂ψ∂φ=∂Φ∂φΘR.{\displaystyle {\frac {{\partial }{\psi }}{{\partial }r}}={\frac {{\partial }R}{{\partial }r}}{\Theta }{\Phi },~~{\frac {{\partial }{\psi }}{{\partial }{\theta }}}={\frac {{\partial }{\Theta }}{{\partial }{\theta }}}R{\Phi },~~{\frac {{\partial }{\psi }}{{\partial }{\varphi }}}={\frac {{\partial }{\Phi }}{{\partial }{\varphi }}}{\Theta }R.}
После подстановки значений частных производных в уравнение Шрёдингера получим:
- 1r2∂∂r(r2∂R∂r)ΘΦ+1r2sin2θ∂2Φ∂φ2ΘR+1r2sinθ∂∂θ(sinθ∂Θ∂θ)RΦ+2mℏ2(E+e2r)RΘΦ=0.{\displaystyle {\frac {1}{r^{2}}}{\frac {\partial }{{\partial }r}}\left({r^{2}}{\frac {{\partial }R}{{\partial }r}}\right){\Theta }{\Phi }+{\frac {1}{{r^{2}}{\sin ^{2}}{\theta }}}{{\frac {{{\partial }^{2}}{\Phi }}{{\partial }{{\varphi }^{2}}}}{\Theta }{R}}+{\frac {1}{{r^{2}}{\sin }{\theta }}}{\frac {\partial }{{\partial }{\theta }}}\left(\sin \theta {\frac {{\partial }{\Theta }}{{\partial }{\theta }}}\right){R}{\Phi }+{\frac {2m}{\hbar ^{2}}}{\left(E+{\frac {e^{2}}{r}}\right){R}{\Theta }{\Phi }}=0.}
Умножим уравнение на r2sin2θRΘΦ:{\displaystyle {\tfrac {r^{2}\sin ^{2}\theta }{R\Theta \Phi }}:}
- sin2θR∂∂r(r2∂R∂r)+1Φ∂2Φ∂φ2+sinθΘ∂∂θ(sinθ∂Θ∂θ)+2mr2sin2θℏ2(E+e2r)=0.{\displaystyle {\frac {{\sin ^{2}}{\theta }}{R}}{\frac {\partial }{{\partial }r}}\left({r^{2}}{\frac {{\partial }R}{{\partial }r}}\right)+{\frac {1}{\Phi }}{\frac {{{\partial }^{2}}{\Phi }}{{\partial }{{\varphi }^{2}}}}+{\frac {\sin \theta }{\Theta }}{\frac {\partial }{{\partial }{\theta }}}\left(\sin \theta {\frac {{\partial }{\Theta }}{{\partial }{\theta }}}\right)+{\frac {2mr^{2}\sin ^{2}\theta }{\hbar ^{2}}}\left(E+{\frac {e^{2}}{r}}\right)=0.}
Второе слагаемое тут зависит только от φ. Перенесём его в правую часть равенства.
- sin2θR∂∂r(r2∂R∂r)+sinθΘ∂∂θ(sinθ∂Θ∂θ)+2mr2sin2θℏ2(E+e2r)=−1Φ∂2Φ∂φ2. (1){\displaystyle {\frac {\sin ^{2}\theta }{R}}{\frac {\partial }{\partial r}}\left(r^{2}{\frac {\partial R}{\partial r}}\right)+{\frac {\sin \theta }{\Theta }}{\frac {\partial }{\partial \theta }}\left(\sin \theta {\frac {\partial \Theta }{\partial \theta }}\right)+{\frac {2mr^{2}\sin ^{2}\theta }{\hbar ^{2}}}\left(E+{\frac {e^{2}}{r}}\right)=-{\frac {1}{\Phi }}{\frac {\partial ^{2}\Phi }{\partial \varphi ^{2}}}.~~~(1)}
Равенство возможно, когда обе части равны какой-то постоянной величине. Обозначим её ml2.{\displaystyle m_{l}^{2}.} Следовательно,
- ∂2Φ∂φ2=−ml2Φ.{\displaystyle {\frac {\partial ^{2}\Phi }{\partial \varphi ^{2}}}=-m_{l}^{2}\Phi .}
Решением этого уравнения являются функции
- Φ=A sin(mlφ), Φ=Acos(mlφ).{\displaystyle \Phi =A~\sin(m_{l}\varphi ),~~\Phi =A\cos(m_{l}\varphi ).}
Угол φ может изменяться от 0 до 2π. Функция Φ{\displaystyle \Phi } должна быть периодической с периодом 2π. Это возможно, только если ml=0,±1,±2,±3,…{\displaystyle m_{l}=0,\pm 1,\pm 2,\pm 3,\dots } Таким образом, из решения уравнения Шрёдингера получаем значение одного из квантовых чисел (конечно, из него можно получить их все). Число ml{\displaystyle m_{l}} называется магнитным квантовым числом.
Далее, интегрируя квадрат модуля функции Φ{\displaystyle \Phi } от 0 до 2π и приравнивая полученное выражение к единице, получим, что A=12π.{\displaystyle A={\tfrac {1}{\sqrt {2\pi }}}.}
Далее рассмотрим левую часть уравнения (1). Она, конечно, равна ml2:{\displaystyle m_{l}^{2}:}
- sin2θR∂∂r(r2∂R∂r)+sinθΘ∂∂θ(sinθ∂Θ∂θ)+2mr2sin2θℏ2(E+e2r)=ml2.{\displaystyle {\frac {\sin ^{2}\theta }{R}}{\frac {\partial }{\partial r}}\left(r^{2}{\frac {\partial R}{\partial r}}\right)+{\frac {\sin \theta }{\Theta }}{\frac {\partial }{\partial \theta }}\left(\sin \theta {\frac {\partial \Theta }{\partial \theta }}\right)+{\frac {2mr^{2}\sin ^{2}\theta }{\hbar ^{2}}}\left(E+{\frac {e^{2}}{r}}\right)=m_{l}^{2}.}
Разделим уравнение на sin2θ:{\displaystyle \sin ^{2}\theta :}
- 1R∂∂r(r2∂R∂r)+1Θsinθ∂∂θ(sinθ∂Θ∂θ)+2mr2ℏ2(E+e2r)=ml2sin2θ.{\displaystyle {\frac {1}{R}}{\frac {\partial }{\partial r}}\left(r^{2}{\frac {\partial R}{\partial r}}\right)+{\frac {1}{\Theta \sin \theta }}{\frac {\partial }{\partial \theta }}\left(\sin \theta {\frac {\partial \Theta }{\partial \theta }}\right)+{\frac {2mr^{2}}{\hbar ^{2}}}\left(E+{\frac {e^{2}}{r}}\right)={\frac {m_{l}^{2}}{\sin ^{2}\theta }}.}
После аналогичного вышеуказанному перенесению второго слагаемого в правую часть и обозначения величины, которой равны эти части, через β,{\displaystyle \beta ,} получаем
- ml2sin2θ−1Θsinθ∂∂θ(sinθ∂Θ∂θ)=β.{\displaystyle {\frac {m_{l}^{2}}{\sin ^{2}\theta }}-{\frac {1}{\Theta \sin \theta }}{\frac {\partial }{\partial \theta }}\left(\sin \theta {\frac {\partial \Theta }{\partial \theta }}\right)=\beta .}
- 1R∂∂r(r2∂R∂r)+2mr2ℏ2(E+e2r)=β.{\displaystyle {\frac {1}{R}}{\frac {\partial }{\partial r}}\left(r^{2}{\frac {\partial R}{\partial r}}\right)+{\frac {2mr^{2}}{\hbar ^{2}}}\left(E+{\frac {e^{2}}{r}}\right)=\beta .}
Решение этих двух последних уравнений приводит к значениям l и n соответственно. Три квантовых числа в совокупности полностью описывают состояния электрона в атоме водорода.
Модуль полной энергии электрона в стационарном состоянии в атоме водорода обратно пропорционален n2.{\displaystyle n^{2}.} Число n называется главным квантовым числом. Оно может иметь значения от 1 до ∞.{\displaystyle \infty .} Его связь с энергией см. ниже.
Число l называется азимутальным квантовым числом и определяет орбитальный момент количества движения электрона и форму электронного облака; может иметь значения от 0 до n − 1 (n здесь относится к энергетическом уровню, на котором находится рассматриваемый электрон).
Магнитное квантовое число ml{\displaystyle m_{l}} определяет проекцию орбитального момента количества движения на выбранную ось в магнитном поле. Эта проекция равна mlℏ.{\displaystyle m_{l}\hbar .}
Математическое описание атома водорода[править | править код]
Энергетический спектр[править | править код]
Энергетические уровни атома водорода, включая подуровни тонкой структуры, записываются в виде
- Enj=E0n2(1+α2n2(nj+12−34)){\displaystyle E_{nj}={\frac {E_{0}}{n^{2}}}\left(1+{\frac {\alpha ^{2}}{n^{2}}}\left({\frac {n}{j+{\frac {1}{2}}}}-{\frac {3}{4}}\right)\right)}
- где
- α{\displaystyle \alpha } — постоянная тонкой структуры,
- j{\displaystyle j} — собственное значение оператора полного момента импульса.
Энергию E0{\displaystyle E_{0}} можно найти в простой модели Бора, с массой электрона me{\displaystyle m_{e}} и зарядом электрона e:
- E0=−mee48h3ε02{\displaystyle E_{0}=-{\frac {m_{e}e^{4}}{8h^{2}\varepsilon _{0}^{2}}}} (в системе СИ),
где h — постоянная Планка, ε0 −{\displaystyle \varepsilon _{0}~-} электрическая постоянная. Величина E0 (энергия связи атома водорода в основном состоянии) равна 13,62323824 эВ = 2,182700518⋅10−18 Дж. Эти значения несколько отличаются от действительного значения E0, поскольку в расчёте не учтена конечная масса ядра и эффекты квантовой электродинамики.
Волновые функции[править | править код]
В сферических координатах волновые функции имеют вид:
- ψnlm(r,θ,φ)=(n−l−1)!2n⋅(n+l)!⋅(2na0)32⋅exp(−rna0)⋅(2rna0)lLn−l−12l+1(2rna0)⋅Yl,m(θ,φ),{\displaystyle \psi _{nlm}(r,\theta ,\varphi )={\sqrt {\frac {(n-l-1)!}{2n{\cdot }(n+l)!}}}{\cdot }{\left({\frac {2}{na_{0}}}\right)}^{\frac {3}{2}}{\cdot }\exp {\left({-{\frac {r}{na_{0}}}}\right)}{\cdot }{\left({\frac {2r}{na_{0}}}\right)}^{l}L_{n-l-1}^{2l+1}{\left({\frac {2r}{na_{0}}}\right)}\cdot Y_{l,m}(\theta ,\varphi ),}
где:
- a0{\displaystyle a_{0}} — Боровский радиус.
- Ln−l−12l+1(
Строение атома водорода (H), схема и примеры
Общие сведения о строении атома водорода
Относится к неметаллам. Заряд ядра равен 1. Атомный вес может варьироваться: 1, 2, 3, что связано с наличием изотопов дейтерия и трития.
Электронное строение атома водорода
В атоме водорода имеется положительно заряженное ядро (+1), 1 протон и один электрон. Поскольку водород имеет самое простейшее строение атома из всех элементов Периодической системы, он хорошо изучен. В 1913 году Нильс Бор предложил схему строения атома водорода, согласно которой положительно заряженное ядро находится в центре, а вокруг него по единственной орбитали движется электрон (рис. 1). В соответствии с этой схемой он вывел спектр излучения этого химического элемента. Который был позже доказан с помощью квантово-механических расчетов уравнения Шредингера (1925-1930 годы).
Рис. 1. Схема строения атома водорода.
Электронная конфигурация атома водорода будет выглядеть следующим образом:
1s1.
Водород относится к семейству s-элементов. Энергетическая диаграмма атома водорода имеет вид:
Единственный электрон, который имеется у водорода является валентным, т.к. участвует в образовании химических связей. В результате взаимодействия водород может как терять электрон, т.е. являться его донором, так и принимать, т.е. быть акцептором. В этих случаях атом превращается либо в положительно, либо отрицательно заряженный ион (H+/Н—):
H0 –e →H+;
H0 +e →H—.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Водород. Физические и химические свойства, получение » HimEge.ru
Водород H — самый распространённый элемент во Вселенной (около 75 % по массе), на Земле — девятый по распространенности. Наиболее важным природным соединением водорода является вода.
Водород занимает первое место в периодической системе (Z = 1). Он имеет простейшее строение атома: ядро атома – 1 протон, окружено электронным облаком, состоящим из 1 электрона.
В одних условиях водород проявляет металлические свойства (отдает электрон), в других — неметаллические (принимает электрон).
В природе встречаются изотопы водорода: 1Н — протий (ядро состоит из одного протона), 2Н — дейтерий (D — ядро состоит из одного протона и одного нейтрона), 3Н — тритий (Т — ядро состоит из одного протона и двух нейтронов).
Простое вещество водород
Молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью.
Физические свойства. Водород — бесцветный нетоксичный газ без запаха и вкуса. Молекула водорода не полярна. Поэтому силы межмолекулярного взаимодействия в газообразном водороде малы. Это проявляется в низких температурах кипения (-252,6 0С) и плавления (-259,2 0С).
Водород легче воздуха, D (по воздуху) = 0,069; незначительно растворяется в воде (в 100 объемах h3O растворяется 2 объема h3). Поэтому водород при его получении в лаборатории можно собирать методами вытеснения воздуха или воды.
Получение водорода
В лаборатории:
1.Действие разбавленных кислот на металлы:
Zn +2HCl → ZnCl2 +H2↑
2.Взаимодействие щелочных и щ-з металлов с водой:
Ca +2H2O → Ca(OH)2 +H2↑
3.Гидролиз гидридов: гидриды металлов легко разлагаются водой с образованием соответствующей щелочи и водорода:
NaH +H2O → NaOH +H2↑
СаH2 + 2Н2О = Са(ОН)2 + 2Н2↑
4.Действие щелочей на цинк или алюминий или кремний:
2Al +2NaOH +6H2O → 2Na[Al(OH)4] +3H2↑
Zn +2KOH +2H2O → K2[Zn(OH)4] +H2↑
Si + 2NaOH + H2O → Na2SiO3 + 2H2
5. Электролиз воды. Для увеличения электрической проводимости воды к ней добавляют электролит, например NаОН, Н2SO4 или Na2SO4. На катоде образуется 2 объема водорода, на аноде — 1 объем кислорода.
2H2O → 2H2+О2
Промышленное получение водорода
1. Конверсия метана с водяным паром, Ni 800 °С (самый дешевый):
CH4 + H2O → CO + 3 H2
CO + H2O → CO2 + H2
В сумме:
CH4 + 2 H2O → 4 H2 + CO
2. Пары воды через раскаленный кокс при 1000оС:
С + H2O → CO + H2
CO +H2O → CO2 + H2
Образующийся оксид углерода (IV) поглощается водой, этим способом получают 50 % промышленного водорода.
3. Нагреванием метана до 350°С в присутствии железного или никелевого катализатора:
СH4 → С + 2Н2↑
4. Электролизом водных растворов KCl или NaCl, как побочный продукт:
2Н2О + 2NaCl→ Cl2↑ + H2↑ + 2NaOH
Химические свойства водорода
- В соединениях водород всегда одновалентен. Для него характерна степень окисления +1, но в гидридах металлов она равна -1.
- Молекула водорода состоит из двух атомов. Возникновение связи между ними объясняется образованием обобщенной пары электронов Н:Н или Н2
- Благодаря этому обобщению электронов молекула Н2 более энергетически устойчива, чем его отдельные атомы. Чтобы разорвать в 1 моль водорода молекулы на атомы, необходимо затратить энергию 436 кДж: Н 2 = 2Н, ∆H° = 436 кДж/моль
- Этим объясняется сравнительно небольшая активность молекулярного водорода при обычной температуре.
- Со многими неметаллами водород образует газообразные соединения типа RН4, RН3, RН2, RН.
1) С галогенами образует галогеноводороды:
Н2 + Cl2 → 2НСl.
При этом с фтором — взрывается, с хлором и бромом реагирует лишь при освещении или нагревании, а с йодом только при нагревании.
2) С кислородом:
2Н2 + О2 → 2Н2О
с выделением тепла. При обычных температурах реакция протекает медленно, выше 550°С — со взрывом. Смесь 2 объемов Н2 и 1 объема О2 называется гремучим газом.
3) При нагревании энергично реагирует с серойь(значительно труднее с селеном и теллуром):
Н2 + S → H
4) С азотом с образованием аммиака лишь на катализаторе и при повышенных температурах и давлениях:
ЗН2 + N2 → 2NН3
5) С углеродом при высоких температурах:
2Н2 + С → СН4 (метан)
6) С щелочными и щелочноземельными металлами образует гидриды (водород – окислитель):
Н2 + 2Li → 2LiH
в гидридах металлов ион водорода заряжен отрицательно (степень окисления -1), то есть гидрид Na+H— построен подобно хлориду Na+Cl—
Со сложными веществами:
7) С оксидами металлов (используется для восстановления металлов):
CuO + H2 → Cu + H2O
Fe3O4 + 4H2 → 3Fe + 4Н2О
8) с оксидом углерода (II):
CO + 2H2 → CH3OH
Синтез — газ (смесь водорода и угарного газа) имеет важное практическое значение, тк в зависимости от температуры, давления и катализатора образуются различные органические соединения, например НСНО, СН 3ОН и другие.
9)Ненасыщенные углеводороды реагируют с водородом, переходя в насыщенные:
СnН2n + Н2 → СnН2n+2.
Молекула водорода — Википедия
Моле́кула водоро́да — простейшая молекула, состоящая из двух атомов водорода. В её состав входят два ядра атомов водорода и два электрона. Вследствие взаимодействия между электронами и ядрами образуется ковалентная химическая связь. Кроме основной изотопной модификации H2, существуют разновидности, в которых один или оба атома протия заменены другими изотопами водорода — дейтерием или тритием: HD, HT, D2, DT, T2. Симметричность или несимметричность молекулы имеет значение при её вращении.
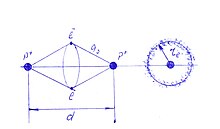
Н.Бор ещё в 1913 году дал описание модели молекулы водорода[1]. Согласно Бору, два внешних электрона, образующих молекулу, вращаются по одной и той же орбите вокруг линии, проходящей через ядра обоих атомов, и удерживают последние на определённом расстоянии друг от друга (рис.1). Боровская модель химической связи давала чёткую картину образования молекулярного водорода — динамическое равновесие системы, содержащей два протона, удерживающихся на определённом расстоянии друг от друга (d), притяжением кольца из двух электронов. При этом модель Нильса Бора учитывала кулоновское отталкивание — оба электрона за счёт электростатического отталкивания находятся в диаметрально противоположных точках электронного кольца вокруг линии, проходящей через ядра обоих атомов молекулы водорода.
Также как и боровская модель атома, боровская модель молекулы водорода не отражала и не могла отражать волновую природу электрона и статистическую интерпретацию волновой функции. Здесь уместно дополнить боровскую модель молекулы водорода достижениями квантовой механики, аналогично боровской модели атома. В этом случае гипотетическое кольцо электронов в модели молекулы водорода трансформируется в геометрическое место расположения плотности вероятности нахождения связывающих электронов. Электронную пару следует представлять электронным облаком в форме кольца, баранки, тора. При этом предполагается, что электроны в торе удалены друг от друга на максимально возможное расстояние, а электронная плотность в молекуле водорода имеет минимум — «кулоновскую дырку» на линии, соединяющей ядра молекулы водорода. Наиболее вероятный радиус электронного тора (r e) определяется боровским радиусом a0 и межъядерным расстоянием (d)
- re2 = a02 — (d/2)2; re = 0,377 Å.
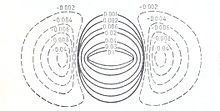
В теории молекулярных орбиталей, разработанной в 1927—1932 г.г. Ф.Хундом, Р.Малликеном и др., модель молекулы водорода описывали контурными картами электронной плотности (рис.2).
Карта строится как разность между электронной плотностью молекулы и несвязанных атомов. Сплошные линии контурной карты отражают области увеличения электронной плотности (в единицах заряда электрона). Пунктирные — области её уменьшения в молекуле по сравнению с электронной плотностью несвязанных атомов водорода, сближенных на равновесное расстояние.[2]
Поскольку в теории молекулярных орбиталей учитывается лишь фермиевская корреляция электронов, поэтому электронная плотность в молекуле водорода сконцентрирована на линии, соединяющей ядра молекулы (см. рис.2).
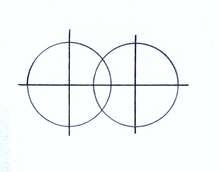 Рис.3.Модель молекулы водорода в теории валентных связей
Рис.3.Модель молекулы водорода в теории валентных связейКвантово-механическую теорию ковалентной связи в молекуле водорода разработали в 1927 году Вальтер Гайтлер и Фриц Лондон. Выполненный ими расчёт волновых функций явился основой теории валентных связей. В этой теории модель молекулы водорода описывали перекрыванием атомных орбиталей атомов водорода (1S типа). Схема перекрывания электронных облаков, образующих сигма-связь молекулы водорода, совпадает с линией соединения атомных центров молекулы (рис.3).
Расчёт молекулы водорода в основном сводится к определению интеграла перекрытия атомных орбиталей.
Гамильтониан молекулы водорода H2 записывается в виде
- H^=−ℏ22MΔR1−ℏ22MΔR2−ℏ22mΔr1−ℏ22mΔr2+e2|R1−R2|+e2|r1−r2|{\displaystyle {\hat {H}}=-{\frac {\hbar ^{2}}{2M}}\Delta _{R_{1}}-{\frac {\hbar ^{2}}{2M}}\Delta _{R_{2}}-{\frac {\hbar ^{2}}{2m}}\Delta _{r_{1}}-{\frac {\hbar ^{2}}{2m}}\Delta _{r_{2}}+{\frac {e^{2}}{|\mathbf {R} _{1}-\mathbf {R} _{2}|}}+{\frac {e^{2}}{|\mathbf {r} _{1}-\mathbf {r} _{2}|}}}
- −e2|R1−r1|−e2|R1−r2|−e2|R2−r1|−e2|R2−r2|{\displaystyle -{\frac {e^{2}}{|\mathbf {R} _{1}-\mathbf {r} _{1}|}}-{\frac {e^{2}}{|\mathbf {R} _{1}-\mathbf {r} _{2}|}}-{\frac {e^{2}}{|\mathbf {R} _{2}-\mathbf {r} _{1}|}}-{\frac {e^{2}}{|\mathbf {R} _{2}-\mathbf {r} _{2}|}}},
где M — масса протона, m — масса электрона, Ri{\displaystyle \mathbf {R} _{i}} — координаты ядер, ri{\displaystyle \mathbf {r} _{i}} — координаты электронов.
В адиабатическом приближении задача нахождения энергетических состояний молекулы водорода разбивается на два этапа. На первом этапе рассматривается только электронная подсистема, а ядра считаются зафиксированными в точках R1{\displaystyle \mathbf {R} _{1}} и R2{\displaystyle \mathbf {R} _{2}}.
Гамильтониан электронной подсистемы имеет вид
- H^el=−ℏ22mΔr1−ℏ22mΔr2+e2|r1−r2|−e2|R1−r1|−e2|R1−r2|−e2|R2−r1|−e2|R2−r2|{\displaystyle {\hat {H}}_{el}=-{\frac {\hbar ^{2}}{2m}}\Delta _{r_{1}}-{\frac {\hbar ^{2}}{2m}}\Delta _{r_{2}}+{\frac {e^{2}}{|\mathbf {r} _{1}-\mathbf {r} _{2}|}}-{\frac {e^{2}}{|\mathbf {R} _{1}-\mathbf {r} _{1}|}}-{\frac {e^{2}}{|\mathbf {R} _{1}-\mathbf {r} _{2}|}}-{\frac {e^{2}}{|\mathbf {R} _{2}-\mathbf {r} _{1}|}}-{\frac {e^{2}}{|\mathbf {R} _{2}-\mathbf {r} _{2}|}}},
Гамильтониан молекулы водорода симметричен относительно переменных r1{\displaystyle \mathbf {r} _{1}} и r2{\displaystyle \mathbf {r} _{2}}, то есть не изменяется при смене нумерации электронов. Кроме того, он не зависит от спиновых переменных.
 Схематическое изображение симметричной волновой функции молекулы водорода и образования ковалентной связи
Схематическое изображение симметричной волновой функции молекулы водорода и образования ковалентной связи 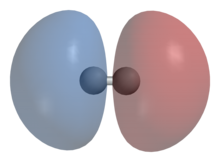 Схематическое изображение антисимметричной волновой функции молекулы водорода
Схематическое изображение антисимметричной волновой функции молекулы водородаИсходя из принципа тождественности частиц и учитывая то, что электроны являются фермионами, волновая функция молекулы водорода должна быть антисимметричной относительно перестановки электронов. Независимость гамильтониана от спиновых переменных позволяет выбрать её в виде произведения двух функций, одна из которых зависит только от координат и называется координатной волновой функцией, а вторая зависит только от спинов и называется спиновой функцией.
Существуют два возможных типа спиновых функций для двух электронов: с параллельными спинами и с антипараллельными спинами. Функции с параллельными спинами симметричны относительно перестановки электронов и образуют триплетные состояния, в которых суммарный спин равен единице. Функции с антипараллельными спинами образуют синглетные состояния с нулевым суммарным спином (см. Мультиплетность, Состояние (квантовая механика)). Они антисимметричны относительно перестановки электронов.
Поскольку волновая функция электрона должна быть антисимметричной относительно перестановки, она может быть произведением либо
- симметричной координатной функции на антисимметричную спиновую функцию, либо
- антисимметричной координатной функции на симметричную спиновую функцию.
Симметричную и антисимметричную координатные функции основного состояния в нулевом приближении теории возмущений можно построить исходя из волновых функций основного состояния атома водорода ψ1s{\displaystyle \psi _{1s}} .
- ψsym=12(ψ1s1(r1)ψ1s2(r2)+ψ1s1(r2)ψ1s2(r1)){\displaystyle \psi _{sym}={\frac {1}{\sqrt {2}}}\left(\psi _{1s1}(\mathbf {r} _{1})\psi _{1s2}(\mathbf {r} _{2})+\psi _{1s1}(\mathbf {r} _{2})\psi _{1s2}(\mathbf {r} _{1})\right)}
- ψasym=12(ψ1s1(r1)ψ1s2(r2)−ψ1s1(r2)ψ1s2(r1)){\displaystyle \psi _{asym}={\frac {1}{\sqrt {2}}}\left(\psi _{1s1}(\mathbf {r} _{1})\psi _{1s2}(\mathbf {r} _{2})-\psi _{1s1}(\mathbf {r} _{2})\psi _{1s2}(\mathbf {r} _{1})\right)}
Первый член каждой из приведенных волновых функций отвечает локализации электрона, пронумерованного индексом 1 на атоме с индексом 1 и электрона, пронумерованного индексом 2 на атоме с индексом 2. Второй член отвечает ситуации, когда первый электрон принадлежит второму атому, а второй — первому. При смене нумерации электронов первая (симметричная) функция не меняется, вторая (антисимметричная) — меняет знак.
Энергия электронных состояний находится усреднением гамильтониана на волновых функциях
- E=∫ψ∗H^ψdV1dV2{\displaystyle {\mathcal {E}}=\int \psi ^{*}{\hat {H}}\psi dV_{1}dV_{2}}.
Для двух возможных волновых функций основного состояния она приобретает вид
- Esym/asym=2E1s+e2R+Q±A1±S2{\displaystyle {\mathcal {E}}_{sym/asym}=2E_{1s}+{\frac {e^{2}}{R}}+{\frac {Q\pm A}{1\pm S^{2}}}},
где R=|R1−R2|{\displaystyle R=|\mathbf {R} _{1}-\mathbf {R} _{2}|} — расстояние между ядрами, E1s{\displaystyle E_{1s}} — значение энергии основного состояния атома водорода, S{\displaystyle S} — интеграл перекрытия, который определяется выражением
- S(R)=∫ψ1s(|r−R1|)ψ1s(|r−R2|)dV{\displaystyle S(R)=\int \psi _{1s}(|\mathbf {r} -\mathbf {R} _{1}|)\psi _{1s}(|\mathbf {r} -\mathbf {R} _{2}|)dV},
Q{\displaystyle Q} — кулоновский интеграл, определяемый как
- Q(R)=e2∫ψ1s2(|r1−R1|)ψ1s2(|r2−R2|)[1|r1−r2|−1|r1−R2|−1|r2−R1|]dV1dV2{\displaystyle Q(R)=e^{2}\int \psi _{1s}^{2}(|\mathbf {r} _{1}-\mathbf {R} _{1}|)\psi _{1s}^{2}(|\mathbf {r} _{2}-\mathbf {R} _{2}|)\left[{\frac {1}{|\mathbf {r} _{1}-\mathbf {r} _{2}|}}-{\frac {1}{|\mathbf {r} _{1}-\mathbf {R} _{2}|}}-{\frac {1}{|\mathbf {r} _{2}-\mathbf {R} _{1}|}}\right]dV_{1}dV_{2}},
A{\displaystyle A} — обменный интеграл, равный
- A(R)=e2∫ψ1s(|r1−R1|)ψ1s(|r2−R2|)ψ1s(|r2−R1|)ψ1s(|r1−R2|)[1|r1−r2|{\displaystyle A(R)=e^{2}\int \psi _{1s}(|\mathbf {r} _{1}-\mathbf {R} _{1}|)\psi _{1s}(|\mathbf {r} _{2}-\mathbf {R} _{2}|)\psi _{1s}(|\mathbf {r} _{2}-\mathbf {R} _{1}|)\psi _{1s}(|\mathbf {r} _{1}-\mathbf {R} _{2}|)\left[{\frac {1}{|\mathbf {r} _{1}-\mathbf {r} _{2}|}}\right.}
- −1|r1−R2|−1|r2−R1|]dV1dV2{\displaystyle \left.-{\frac {1}{|\mathbf {r} _{1}-\mathbf {R} _{2}|}}-{\frac {1}{|\mathbf {r} _{2}-\mathbf {R} _{1}|}}\right]dV_{1}dV_{2}}.
Энергия молекулы водорода состоит из удвоенной энергии атома водорода, энергии кулоновского отталкивания между ядрами и членов, определяющих взаимодействие электронов между собой и с другим ядром. В зависимости от спинового состояния в формуле для E{\displaystyle {\mathcal {E}}} следует выбирать знак «+» или знак «-». Знак «+» отвечает синглетному состоянию, знак «-» — триплетному.
Величина Q(R){\displaystyle Q(R)} — это средняя энергия кулоновского взаимодействия между двумя электронами и электронов с «чужим ядром». Величина A(R){\displaystyle A(R)} определяет вклад в энергию обменного взаимодействия, которая не имеет аналога в классической механике. Именно этот член определяет существенное различие между синглетными и триплетными состояниями.
Зависимость энергии основного состояния от расстояния между ядрами[править | править код]
Ковалентная связь[править | править код]
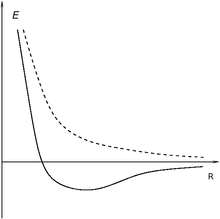 Энергия взаимодействия атомов в молекуле водорода для синглетного(сплошная линия) и триплетного (пунктирная линия) состояний
Энергия взаимодействия атомов в молекуле водорода для синглетного(сплошная линия) и триплетного (пунктирная линия) состоянийОбменный интеграл для молекулы водорода в определённом диапазоне расстояний между атомами отрицательный. Вследствие этого, для синглетных состояний он обеспечивает дополнительное притягивание между ядрами атомов, а для триплетных — дополнительное отталкивание. Дополнительное притягивание обусловливает появление минимума электронной энергии на расстоянии приблизительно в 1,5 радиуса Бора (что соответствует приблизительно 75 пм). Этот минимум возникает только для синглетного состояния, то есть для антипараллельных спинов. Таким образом устанавливается ковалентная связь между атомами. Электроны двух атомов водорода «спариваются».
Насыщение ковалентной связи[править | править код]
Для параллельных спинов, то есть для триплетного состояния, дополнительный положительный вклад в энергию приводит к тому, что атомы отталкиваются на любом расстоянии. Этим объясняется насыщение ковалентной связи. Молекула водорода может состоять только из двух атомов. Третий атом водорода не может образовать связь с молекулой потому, что его спин непременно будет параллельным одному из спинов электронов в составе молекулы. Параллельность спинов приводит к отталкиванию между ядрами на любом расстоянии.
Необходимо отметить, что на больших расстояниях между атомами они притягиваются в любых состояниях благодаря Ван-дер-Ваальсовому взаимодействию, которое, однако, намного слабее ковалентной связи. Ван-дер-Ваальсово взаимодействие не учитывается в приведенной теории, поскольку требует рассмотрения возбуждённых состояний высших, чем 1s-орбиталь.
Гамильтониан, описывающий относительное движение двух ядер в молекуле водорода имеет вид
- H^nucl=−ℏ22μR2∂∂R(R2∂∂R)+L^22μR2+Esym(R){\displaystyle {\hat {H}}_{nucl}=-{\frac {\hbar ^{2}}{2\mu R^{2}}}{\frac {\partial }{\partial R}}\left(R^{2}{\frac {\partial }{\partial R}}\right)+{\frac {{\hat {L}}^{2}}{2\mu R^{2}}}+{\mathcal {E}}_{sym}(R)},
где μ=M/2{\displaystyle \mu =M/2} — приведённая масса двух ядер, Esym(R){\displaystyle {\mathcal {E}}_{sym}(R)} — энергия синглетного электронного состояния, зависящая от расстояния между ядрами (определена в предыдущем разделе), L^{\displaystyle {\hat {L}}} — оператор углового момента, описывающий вращение молекулы.
Вращение[править | править код]
Оператор углового момента коммутирует с гамильтонианом, поэтому собственные функции гамильтониана можно выбрать общими с собственными функциями оператора углового момента, то есть сферические гармоники:
- L^2Ylm=ℏ2l(l+1)Ylm{\displaystyle {\hat {L}}^{2}Y_{lm}=\hbar ^{2}l(l+1)Y_{lm}}.
Вклад вращения в энергию молекулы равен
- Erot=ℏ2l(l+1)2μR2{\displaystyle E_{rot}={\frac {\hbar ^{2}l(l+1)}{2\mu R^{2}}}}.
Этот вклад мал, потому, что массы ядер намного больше, чем массы электронов. Он зависит от расстояния между ядрами R. При колебаниях ядер это расстояние меняется, поэтому вращательное движение, строго говоря, невозможно отделить от колебательного. Однако при малых l и при малых энергиях колебательного движения можно считать, что R равняется определённому среднему значению.
Вращательные уровни вырождены относительно магнитного квантового числа ml. Кратность вырождения 2l+1.
Колебания атомов[править | править код]
Вблизи минимума функцию Esym(R)+ℏ2l(l+1)2μR2{\displaystyle {\mathcal {E}}_{sym}(R)+{\frac {\hbar ^{2}l(l+1)}{2\mu R^{2}}}} можно разложить в ряд Тейлора, ограничившись только квадратичным членом.
- U(R)≈Esym(R)+ℏ2l(l+1)2μR2=E(R0)+ℏ2l(l+1)2μR02+μω22(R−R02){\displaystyle U(R)\approx {\mathcal {E}}_{sym}(R)+{\frac {\hbar ^{2}l(l+1)}{2\mu R^{2}}}={\mathcal {E}}(R_{0})+{\frac {\hbar ^{2}l(l+1)}{2\mu R_{0}^{2}}}+{\frac {\mu \omega ^{2}}{2}}(R-R_{0}^{2})},
где
- μω2=d2UdR2|R=R0{\displaystyle \mu \omega ^{2}=\left.{\frac {d^{2}U}{dR^{2}}}\right|_{R=R_{0}}}
Таким образом, задача об энергетических состояниях колебания ядер сводится к задаче квантового гармонического осциллятора. Следовательно, для низших колебательных и вращательных уровней энергия молекулы водорода равна
- Es,n,l=Esym(R0)+ℏ2l(l+1)2μR2+ℏω(v+12){\displaystyle E_{s,n,l}={\mathcal {E}}_{sym}(R_{0})+{\frac {\hbar ^{2}l(l+1)}{2\mu R^{2}}}+\hbar \omega \left(v+{\frac {1}{2}}\right)},
где v=0,1…{\displaystyle v=0,1\ldots } — колебательное квантовое число.
Низшая энергия колебания ℏω2{\displaystyle {\frac {\hbar \omega }{2}}} отвечает нулевым колебаниям.
При больших значениях квантовых чисел n и l колебательное и вращательное движение разделить невозможно.
Таким образом, энергию молекулы при малых квантовых числах можно записать в виде трёх слагаемых — электронного, колебательного и вращательного:
- Es,n,l=Eel+Ev+Er{\displaystyle E_{s,n,l}=E_{el}+E_{v}+E_{r}}
Малым параметром задачи является отношение массы электрона к массе протона. Электронное слагаемое не зависит от этого отношения, колебательное пропорционально m/M{\displaystyle {\sqrt {m/M}}}
Производство водорода — Википедия
Электролизёр — оборудование для производства водорода из водыПромышленное производство водорода — неотъемлемая часть водородной энергетики, первое звено в жизненном цикле употребления водорода. Водород практически не встречается на Земле в чистом виде и должен извлекаться из других соединений с помощью различных химических методов.
Разнообразие способов получения водорода является одним из главных преимуществ водородной энергетики, так как повышает энергетическую безопасность и снижает зависимость от отдельных видов сырья.
К ним относятся:[источник не указан 1585 дней]
В данный момент наиболее доступным и дешёвым процессом является паровая конверсия. Согласно прогнозам, она будет использоваться в начальной стадии перехода к водородной экономике для упрощения преодоления проблемы «курицы и яйца», когда из-за отсутствия инфраструктуры нет спроса на водородные автомобили, а из-за отсутствия водородных автомобилей не строится инфраструктура. В долгосрочной перспективе, однако, необходим переход на возобновляемые источники энергии, так как одной из главных целей внедрения водородной энергетики является снижения выброса парниковых газов. Такими источниками может быть энергия ветра или солнечная энергия, позволяющая проводить электролиз воды.
В 2019 г. в Германии началось строительство крупнейшей в мире установки по производству 1300 тонн водорода ежегодно методом электролиза.[1]
Производство водорода может быть сосредоточено на централизованных крупных предприятиях, что понижает себестоимость производства, но требует дополнительных расходов на доставку водорода к водородным автозаправочным станциям. Другим вариантом является маломасштабное производство непосредственно на специально оборудованных водородных автозаправочных станциях.
Производство водорода из различных источников сырья[править | править код]
На 2019 год в мире потребляется 75 млн тонн водорода, в основном в нефтепереработке и производстве аммиака. Из них более 3/4 производится из природного газа, для чего расходуется более 205 млрд м3 газа.[2] Почти все остальное получают из угля. Около 0,1 % (~100 тыс. тонн) вырабатывается электролизом. При производстве водорода в атмосферу поступает ~830 млн тонн CO2. Себестоимость водорода из природного газа оценивается в 1,5-3 доллара за 1 кг.
Из метана[править | править код]
Паровая конверсия с водяным паром при 1000 °C:
- Ch5+h3O ⇄ CO+3h3{\displaystyle {\mathsf {CH_{4}+H_{2}O\ \rightleftarrows {}\ CO+3H_{2}}}}
Водород можно получать разной чистоты: 95-98 % или особо чистый. В зависимости от дальнейшего использования водород получают под различным давлением: от 1,0 до 4,2 МПа. Сырье (природный газ или легкие нефтяные фракции) подогревается до 350—400° в конвективной печи или теплообменнике и поступает в аппарат десульфирования. Конвертированный газ из печи охлаждается в печи-утилизаторе, где вырабатывается пар требуемых параметров. После ступеней высокотемпературной и низкотемпературной конверсии СО газ поступает на адсорбцию СО2 и затем на метанирование остаточных оксидов. В результате получается водород 95-98,5 % чистоты с содержанием в нем 1-5 % метана и следов СО и СО2..
В том случае, если требуется получать особо чистый водород, установка дополняется секцией адсорбционного разделения конвертированного газа. В отличие от предыдущей схемы конверсия СО здесь одноступенчатая. Газовая смесь, содержащая H2, CO2, CH4, H2O и небольшое количество СО, охлаждается для удаления воды и направляется в адсорбционные аппараты, заполненные цеолитами. Все примеси адсорбируются в одну ступень при температуре окружающей среды. В результате получают водород со степенью чистоты 99,99 %. Давление получаемого водорода составляет 1,5-2,0 МПа.
Также возможно каталитическое окисление кислородом:
- 2Ch5+O2⇄ 2CO+4h3{\displaystyle {\mathsf {2CH_{4}+O_{2}\rightleftarrows {}\ 2CO+4H_{2}}}}
Из угля[править | править код]
Пропускание паров воды над раскалённым углем при температуре около 1000 °C:
- h3O+C ⇄ CO↑+h3↑{\displaystyle {\mathsf {H_{2}O+C\ \rightleftarrows {}\ CO\uparrow +H_{2}\uparrow }}}
Старейший способ получения водорода. Себестоимость процесса $2-$2,5 за килограмм водорода. В будущем возможно снижение цены до $1,50, включая доставку и хранение.
Электролиз[править | править код]
Электролиз водных растворов солей:
- 2NaCl+2h3O → 2NaOH+Cl2↑+h3↑{\displaystyle {\mathsf {2NaCl+2H_{2}O\ {\xrightarrow {}}\ 2NaOH+Cl_{2}\uparrow +H_{2}\uparrow }}}
Электролиз водных растворов гидроксидов активных металлов (преимущественно, гидроксида калия)[3]
- 2h3O→4e−2h3↑+O2↑{\displaystyle {\ce {2h3O ->[4e^{-}] 2h3 ^ + O2 ^}}}
Кроме того, существует промышленная технология электролиза химически чистой воды, без применения каких-либо добавок. Фактически, устройство представляет собой обратимый топливный элемент с твёрдой полимерной мембраной[3].
Из биомассы[править | править код]
Водород из биомассы получается термохимическим, или биохимическим способом. При термохимическом методе биомассу нагревают без доступа кислорода до температуры 500°-800° (для отходов древесины), что намного ниже температуры процесса газификации угля. В результате процесса выделяется H2, CO и CH4.
Себестоимость процесса $5-$7 за килограмм водорода. В будущем возможно снижение до $1,0-$3,0.
В биохимическом процессе водород вырабатывают различные бактерии, например, Rodobacter speriodes.
Возможно применение различных энзимов для ускорения производства водорода из полисахаридов (крахмал, целлюлоза), содержащихся в биомассе. Процесс проходит при температуре 30° Цельсия при нормальном давлении. Себестоимость процесса около $2 за кг.
Из цепочки сахар-водород-водородный топливный элемент можно получить[4] в три раза больше энергии, чем из цепочки сахар-этанол-двигатель внутреннего сгорания.
Из мусора[править | править код]
Разрабатываются различные новые технологии производства водорода. Например, в октябре 2006 года Лондонское Водородное Партнёрство опубликовало исследование (недоступная ссылка) о возможности производства водорода из муниципального и коммерческого мусора. Согласно исследованию, в Лондоне можно ежедневно производить 141 тонну водорода как пиролизом, так и анаэробным сбраживанием мусора. Из муниципального мусора можно производить 68 тонн водорода.
141 тонны водорода достаточно для работы 13750 автобусов с двигателями внутреннего сгорания, работающими на водороде. В Лондоне в настоящее время эксплуатируется более 8000 автобусов.
Химическая реакция воды с металлами[править | править код]
В 2007 году Университет Purdue (США) разработал метод производства водорода из воды при помощи алюминиевого сплава.
Сплав алюминия с галлием формируется в пеллеты. Пеллеты помещают в бак с водой. В результате химической реакции производится водород. Галлий препятствует образованию оксидной пленки на поверхности алюминия, тормозящую процесс окисления алюминия. В результате реакции создаётся водород и оксид алюминия.
Из одного фунта (≈453 г) алюминия можно получать более 2 кВт·ч энергии от сжигания водорода и более 2 кВт·ч тепловой энергии во время реакции алюминия с водой. В будущем, при использовании электроэнергии атомных реакторов 4-го поколения, себестоимость водорода, получаемого в ходе реакции, станет эквивалента цене бензина $3 за галлон (≈3,8 л).
Автомобиль среднего размера с двигателем внутреннего сгорания с 350 фунтами (158 кг) алюминия на борту может проехать 350 миль (560 км). В будущем стоимость такой поездки составит $63 (0,11 $/км), включая стоимость восстановления оксида алюминия на атомной электростанции 4-го поколения.[5]
С использованием водорослей[править | править код]
Учёные калифорнийского университета в Беркли (UC Berkeley) 1999 году обнаружили[6], что если водорослям не хватает кислорода и серы, то процессы фотосинтеза у них резко ослабевают, и начинается бурная выработка водорода.
Водород может производить группа зелёных водорослей, например, Chlamydomonas reinhardtii. Водоросли могут производить водород из морской воды, или канализационных стоков.
Домашние системы производства водорода[править | править код]
Вместо строительства водородных заправочных станций водород можно производить в бытовых установках из природного газа, или электролизом воды. Honda испытывает свою бытовую установку под названием Домашняя энергетическая станция Honda. Установка в бытовых условиях производит водород из природного газа. Часть водорода используется в топливных элементах для производства тепловой и электрической энергии для дома. Оставшаяся часть водорода используется для заправки автомобиля.
Британская компания ITM Power Plc разработала и испытала в 2007 г. бытовой электролизёр для производства водорода. Водород производится ночью, что позволит сгладить пики потребления электроэнергии. Электролизер мощностью 10 кВт производит из воды водород, и хранит его под давлением 75 бар. Произведённого водорода достаточно для 40 км пробега битопливного (водород/бензин) Ford Focus. Компания планирует начать производство бытовых электролизеров в начале 2008 года. ITM Power уже достигла уровня себестоимости электролизеров $164 за 1кВт.
Водород — Википедия
| Водород | |
|---|---|
| Гелий → | |
| Газ без цвета, запаха и вкуса | |
 Водород в разрядной трубке | |
| Название, символ, номер | Водород / Hydrogenium (H), 1 |
| Атомная масса (молярная масса) | [1,00784; 1,00811][комм 1][1] а. е. м. (г/моль) |
| Электронная конфигурация | 1s1 |
| Радиус атома | 53 пм |
| Ковалентный радиус | 32 пм |
| Радиус иона | 54 (−1 e) пм |
| Электроотрицательность | 2,20[2] (шкала Полинга) |
| Степени окисления | +1, 0, −1 |
| Энергия ионизации (первый электрон) | 1311,3 (13,595) кДж/моль (эВ) |
| Плотность (при н. у.) | 0,0000899 (при 273 K (0 °C)) г/см³ |
| Температура плавления | 14,01 K; −259,14 °C |
| Температура кипения | 20,28 K; −252,87 °C |
| Уд. теплота плавления | 0,117 кДж/моль |
| Уд. теплота испарения | 0,904 кДж/моль |
| Молярная теплоёмкость | 28,47[3] Дж/(K·моль) |
| Молярный объём | 14,1 см³/моль |
| Структура решётки | гексагональная |
| Параметры решётки | a = 3,780 c = 6,167 Å |
| Отношение c/a | 1,631 |
| Температура Дебая | 110 K |
| Теплопроводность | (300 K) 0,1815 Вт/(м·К) |
| Номер CAS | 12385-13-6 |
 | |
Водоро́д (H, лат. hydrogenium) — химический элемент периодической системы с обозначением H и атомным номером 1, самый лёгкий из элементов периодической таблицы. Его одноатомная форма — самое распространённое химическое вещество во Вселенной, составляющее примерно 75 % всей барионной массы. Звёзды, кроме компактных, в основном состоят из водородной плазмы.
Три изотопа водорода имеют собственные названия: 1H — протий, 2H — дейтерий и 3H — тритий (радиоактивен). Ядро самого распространённого изотопа, протия, состоит из одного только протона и не содержит нейтронов.
При стандартных температуре и давлении водород — бесцветный, не имеющий запаха и вкуса, нетоксичный двухатомный газ с химической формулой H2, который в смеси с воздухом или кислородом горюч и крайне пожаро- и взрывоопасен[3]. В присутствии других окисляющих газов, например фтора или хлора, водород также взрывоопасен. Поскольку водород охотно формирует ковалентные связи с большинством неметаллов, большая часть водорода на Земле существует в молекулярных соединениях, таких как вода или органические вещества. Водород играет особенно важную роль в кислотно-основных реакциях.
Растворим в этаноле и ряде металлов: железе, никеле, палладии, титане, платине, ниобии.
Выделение горючего газа при взаимодействии кислот и металлов наблюдали в XVI и XVII веках на заре становления химии как науки. Впервые водород получил Парацельс, погружая железные опилки в серную кислоту в XVI веке.
В 1671 году Роберт Бойль подробно описал реакцию между железными опилками и разбавленными кислотами, при которой выделяется газообразный водород[4][5].
В 1766 году Генри Кавендиш был первым, кто признал газообразный водород индивидуальным элементом, назвав газ, выделяющийся при реакции металла с кислотой «горючим воздухом». Он предположил, что «горючий воздух» идентичен гипотетическому веществу, называемому «флогистон», и в 1781 году обнаружил, что при его сгорании образуется вода[6][7].
Прямо указывал на выделение водорода и Михаил Ломоносов, но он уже понимал, что это не флогистон.
Французский химик Антуан Лавуазье совместно с инженером Жаном Мёнье, используя специальные газометры, в 1783 году осуществил синтез воды, а затем и её анализ, разложив водяной пар раскалённым железом. Так он установил, что «горючий воздух» входит в состав воды и может быть из неё получен.
Лавуазье дал водороду название hydrogène (от др.-греч. ὕδωρ — вода и γεννάω — рождаю) — «рождающий воду». В 1801 году последователь Лавуазье, академик Василий Севергин, называл его «водотворное вещество», он писал[8]:
Водотворное вещество в соединении с кислотворным составляет воду. Сие можно доказать, как через разрешение, так и через составление.
Русское наименование «водород» предложил химик Михаил Соловьёв в 1824 году — по аналогии с «кислородом» Ломоносова.
Во Вселенной[править | править код]
В настоящее время водород — самый распространённый элемент во Вселенной[9]. На его долю приходится около 88,6 % всех атомов (около 11,3 % составляют атомы гелия, доля всех остальных вместе взятых элементов — порядка 0,1 %)[10]. Таким образом, водород — основная составная часть звёзд и межзвёздного газа. Повсеместное возникновение атомарного водорода впервые произошло в эпоху рекомбинации.
В условиях звёздных температур (например, температура поверхности Солнца ~6000 °C) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре.
Земная кора и живые организмы[править | править код]
Массовая доля водорода в земной коре составляет 1 % — это десятый по распространённости элемент. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17 % (второе место после кислорода, доля атомов которого равна ~52 %). Поэтому значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода.
В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере (0,00005 % по объёму для сухого воздуха[11][12]).
Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках, где по числу атомов на водород приходится почти 63 %[13].
В промышленности[править | править код]
На 2019 год в мире потребляется 75 млн тонн водорода, в основном в нефтепереработке и производстве аммиака. Из них более 3/4 производится из природного газа, для чего расходуется более 205 млрд м3 газа.[14] Почти все остальное получают из угля. Около 0,1 % (~100 тыс. тонн) вырабатывается электролизом. При производстве водорода в атмосферу поступает ~830 млн тонн CO2. Себестоимость водорода из природного газа оценивается в 1,5-3 доллара за 1 кг.
- Ch5+h3O ⇄ CO+3h3{\displaystyle {\mathsf {CH_{4}+H_{2}O\ \rightleftarrows {}\ CO+3H_{2}}}}
- Пропускание паров воды над раскалённым коксом при температуре около 1000 °C:
- h3O+C ⇄ CO↑+h3↑{\displaystyle {\mathsf {H_{2}O+C\ \rightleftarrows {}\ CO\uparrow +H_{2}\uparrow }}}
- 2NaCl+2h3O → 2NaOH+Cl2↑+h3↑{\displaystyle {\mathsf {2NaCl+2H_{2}O\ {\xrightarrow {}}\ 2NaOH+Cl_{2}\uparrow +H_{2}\uparrow }}}
- 2h3O→4e−2h3↑+O2↑{\displaystyle {\ce {2h3O ->[4e^{-}] 2h3 ^ + O2 ^}}}
- Кроме того, существует промышленная технология электролиза химически чистой воды, без применения каких-либо добавок. Фактически, устройство представляет собой обратимый топливный элемент с твёрдой полимерной мембраной[15] (англ.).
- 2Ch5+O2⇄ 2CO+4h3{\displaystyle {\mathsf {2CH_{4}+O_{2}\rightleftarrows {}\ 2CO+4H_{2}}}}
В лаборатории[править | править код]
- Zn+h3SO4→ZnSO4+h3↑{\displaystyle {\mathsf {Zn+H_{2}SO_{4}\rightarrow ZnSO_{4}+H_{2}\uparrow }}}
- Ca+2h3O→Ca(OH)2+h3↑{\displaystyle {\mathsf {Ca+2H_{2}O\rightarrow Ca(OH)_{2}+H_{2}\uparrow }}}
- NaH+h3O→NaOH+h3↑{\displaystyle {\mathsf {NaH+H_{2}O\rightarrow NaOH+H_{2}\uparrow }}}
- 2Al+2NaOH+6h3O→2Na[Al(OH)4]+3h3↑{\displaystyle {\mathsf {2Al+2NaOH+6H_{2}O\rightarrow 2Na[Al(OH)_{4}]+3H_{2}\uparrow }}}
- Zn+2KOH+2h3O→K2[Zn(OH)4]+h3↑{\displaystyle {\mathsf {Zn+2KOH+2H_{2}O\rightarrow K_{2}[Zn(OH)_{4}]+H_{2}\uparrow }}}
- 2h4O++2e−→2h3O+h3↑{\displaystyle {\mathsf {2H_{3}O^{+}+2e^{-}\rightarrow 2H_{2}O+H_{2}\uparrow }}}
Очистка[править | править код]
В промышленности реализованы несколько способов очистки водорода из углерод-содержащего сырья (т. н. водородсодержащий газ — ВСГ)[16].
- Низкотемпературная конденсация: ВСГ охлаждают до температур конденсации метана и этана, после чего водород отделяют ректификацией. Процесс ведут при температуре −158 °C и давлении 4 МПа. Чистота очищенного водорода составляет 93—94 % при его концентрации в исходном ВСГ до 40 %.
- Адсорбционное выделение на цеолитах: Настоящий метод на сегодняшний день наиболее распространён в мире. Метод достаточно гибок и может использоваться как для выделения водорода из ВСГ, так и для доочистки уже очищенного водорода. В первом случае процесс ведут при давлениях 3,0—3,5 МПа. Степень извлечения водорода составляет 80-85 % с чистотой 99 %. Во втором случае часто используют процесс «PSA» фирмы «Union Carbide». Он впервые был реализован в промышленности в 1978 году. На настоящий момент функционирует более 250 установок от 0,6 до 3,0 млн м3 Н2/сут. Образуется водород высокой чистоты 99,99 %.
- Абсорбционное выделение жидкими растворителями: Этот метод применяется редко, хотя водород получается высокой чистоты 99,9 %.
- Концентрирование водорода на мембранах: На лучших образцах метод позволяет получать водород чистотой 95-96 %, однако производительность таких установок невысока.
- Селективное поглощение водорода металлами: Метод основан на способности сплавов лантана с никелем, железа с титаном, циркония с никелем и других поглощать до 30 объёмов водорода.
Стоимость[править | править код]
Стоимость водорода при крупнооптовых поставках колеблется в диапазоне 2—7 USD/кг.[17] В небольших количествах перевозится в стальных баллонах зелёного или тёмно-зелёного цвета.
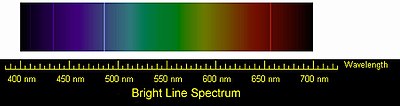
 Эмиссионный спектр атомов водорода. Четыре видимые глазом спектральные линии серии Бальмера
Эмиссионный спектр атомов водорода. Четыре видимые глазом спектральные линии серии БальмераВодород — самый лёгкий газ: он легче воздуха в 14,5 раз. Поэтому, например, мыльные пузыри, наполненные водородом, на воздухе стремятся вверх[18]. Чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в 7 раз выше теплопроводности воздуха.
Молекула водорода двухатомна — Н2. При нормальных условиях это газ без цвета, запаха и вкуса. Плотность 0,08987 г/л (н. у.), температура кипения −252,76 °C, удельная теплота сгорания 120,9⋅106 Дж/кг, малорастворим в воде — 18,8 мл/л.
Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.), особенно в палладии (850 объёмов H2 на 1 объём Pd). С растворимостью водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия водорода с углеродом (так называемая декарбонизация). Практически не растворим в серебре.
Жидкий водород существует в очень узком интервале температур от −252,76 до −259,2 °C. Это бесцветная жидкость, очень лёгкая (плотность при −253 °C 0,0708 г/см³) и текучая (вязкость при −253 °C 13,8 сП). Критические параметры водорода очень низкие: температура −240,2 °C и давление 12,8 атм. Этим объясняются трудности при ожижении водорода. В жидком состоянии равновесный водород состоит из 99,79 % пара-Н2, 0,21 % орто-Н2[⇨].
Твёрдый водород, температура плавления −259,2 °C, плотность 0,0807 г/см³ (при −262 °C) — снегоподобная масса, кристаллы гексагональной сингонии, пространственная группа P6/mmc, параметры ячейки a = 0,378 нм и c = 0,6167 нм.
В 1935 году Уингер и Хунтингтон высказали предположение о том, что при давлении свыше 250 тысяч атм водород может перейти в металлическое состояние. Получение этого вещества в устойчивом состоянии открывало очень заманчивые перспективы его применения — ведь это был бы сверхлёгкий металл, компонент лёгкого и энергоёмкого ракетного топлива. В 2014 году было установлено, что при давлении порядка 1,5—2,0 млн атм водород начинает поглощать инфракрасное излучение, а это означает, что электронные оболочки молекул водорода поляризуются. Возможно, при ещё более высоких давлениях водород превратится в металл[19]. В 2017 году появилось сообщение о возможном экспериментальном наблюдении перехода водорода в металлическое состояние под высоким давлением[20][21].
Молекулярный водород существует в двух спиновых формах (модификациях): ортоводород и параводород. Модификации немного различаются по физическим свойствам, оптическим спектрам, также по характеристикам рассеивания нейтронов. В молекуле ортоводорода o-H2 (т. пл. −259,10 °C, т. кип. −252,56 °C) спины ядер параллельны, а у параводорода p-H2 (т. пл. −259,32 °C, т. кип. −252,89 °C) — противоположно друг другу (антипараллельны). Равновесная смесь o-H2 и p-H2 при заданной температуре называется равновесный водород e-H2.
Равновесная мольная концентрация параводорода в смеси в зависимости от температурыРазделить модификации водорода можно адсорбцией на активном угле при температуре жидкого азота. При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону параводорода, так как энергия пара-молекулы немного ниже энергии орто-молекулы. При 80 К соотношение модификаций приблизительно 1:1. Десорбированный с угля параводород при нагревании превращается в ортоводород с образованием равновесной смеси. При комнатной температуре равновесна смесь ортоводорода и параводорода в отношении около 75:25[22]. Без катализатора взаимное превращение происходит относительно медленно, что даёт возможность изучить свойства обеих модификаций. В условиях разреженной межзвёздной среды характерное время перехода в равновесную смесь очень велико, вплоть до космологических.
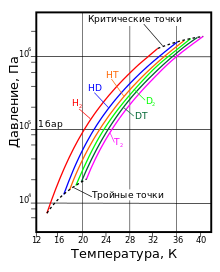 Термодинамическое состояние насыщенного пара водорода с различным изотопным составом
Термодинамическое состояние насыщенного пара водорода с различным изотопным составомНаиболее известны три изотопа водорода: протий 1H (атомное ядро — протон), дейтерий 2Н (ядро состоит из одного протона и одного нейтрона) и тритий 3Н (ядро состоит из одного протона и двух нейтронов). Эти изотопы имеют собственные химические символы: протий — H, дейтерий — D, тритий — T.
Протий и дейтерий стабильны. Содержание этих изотопов в природном водороде составляет 99,9885 ± 0,0070 % и 0,0115 ± 0,0070 % соответственно[23]. Оно может незначительно меняться в зависимости от источника и способа получения водорода. Тритий нестабилен, претерпевает бета-распад с периодом 12,32 года, превращаясь в стабильный гелий-3[23]. Тритий встречается в природе в следовых количествах, образуясь главным образом при взаимодействии космических лучей со стабильными ядрами, при захвате дейтерием тепловых нейтронов и при взаимодействии природного изотопа лития-6 с нейтронами, порождёнными космическими лучами.
Искусственно получены также тяжёлые радиоактивные изотопы водорода с массовыми числами 4—7 и периодами полураспада 10−21—10−23 с[23].
Природный молекулярный водород состоит из молекул H2 и HD (дейтероводород) в соотношении 3200:1. Содержание в нём молекул из чистого дейтерия D2 ещё меньше, отношение концентраций HD и D2 составляет примерно 6400:1.
Из всех изотопов химических элементов физические свойства изотопов водорода отличаются друг от друга наиболее сильно. Это связано с наибольшим относительным изменением масс атомов[24].
Температура
плавления,
KТемпература
кипения,
KТройная
точкаКритическая
точкаПлотность,
кг/м³T, K P, кПа T, K P, МПа жидкий газ H2 13,96 20,39 13,96 7,3 32,98 1,31 70,811 1,316 HD 16,65 22,13 16,6 12,8 35,91 1,48 114,0 1,802 HT 22,92 17,63 17,7 37,13 1,57 158,62 2,31 D2 18,65 23,67 18,73 17,1 38,35 1,67 162,50 2,23 DT 24.38 19,71 19,4 39,42 1,77 211,54 2,694 T2 20,63 25,04 20,62 21,6 40,44 1,85 260,17 3,136
Молекулы чистых протия, дейтерия и трития могут существовать в двух аллотропных модификациях (отличающихся взаимной ориентацией спинов ядер) — орто- и параводород: o-D2, p-D2, o-T2, p-T2. Молекулы водорода с другим изотопным составом (HD, HT, DT) не имеют орто- и парамодификаций.
Свойства изотопов[
Особенности строения атома водорода :: SYL.ru
Самый распространенный элемент в космосе, состоящий из самых легких атомов, — это водород. Он открыт еще в 14 столетии великим алхимиком Парацельсом. Ученого по праву считают основоположником не только медицины, но и химии. Строение атома водорода было в дальнейшем детально рассмотрено Нильсом Бором. Элемент был затем обнаружен астрономами в составе Солнца и других планет, а также в газовых звездных туманностях. В них происходит процесс превращения атомов водорода в атомы гелия, иными словами, наблюдается ядерная реакция. В нашей статье мы изучим не только строение атома водорода, но и рассмотрим характерные особенности свойств этого химического элемента.
Место элемента в периодической системе Менделеева
Водород – единственный химический элемент, находящийся сразу в двух группах периодической системы: 1 и 7. Объяснить следующий факт можно так: он проявляет двойственные химические свойства. Особое строение атома водорода позволяет ему отдавать свой единственный электрон атомам, например, активных элементов – неметаллов. Это прежде всего галогены: агрессивные по своим свойствам фтор, хлор, бром и йод. Легко взаимодействует H2 и с халькогенами: серой, кислородом, селеном. В этом случае атомы водорода превращаются в катионы – положительно заряженные частицы.
Благодаря этой особенности элемент занимает место в первой группе периодической системы. Иначе выглядит механизм реакции между металлами и водородом. Согласно теории строения атома водорода по Н. Бору, элемент имеет один неспаренный электрон. Атом H принимает электроны от атомов активных щелочных или щелочноземельных металлов. Таким образом, его электронная конфигурация становится похожей на частицу инертного газа гелия. Единственный энергетический слой теперь полностью завершен. В данных процессах строение атома водорода изменяется и он переходит в форму аниона. Именно по этой причине элемент одновременно располагается в периодической системе еще и в ее 7 группе.

Все в сравнении
Продолжая изучать особенности строения водородных частиц, давайте посмотрим, насколько их внутренняя структура влияет на поведение элемента в реакциях. Для этого обратим внимание на его ближайших соседей по периодической системе и определим, каково строение атомов водорода, гелия и лития. С частицами инертного газа водород объединяет одинаковое количество энергетических уровней, с литием – похожее строение внешнего энергетического слоя, на котором расположен один электрон. Однако свойства водорода сильно отличаются как от инертного газа, так и от щелочного металла. Этот факт доказывает, что все характеристики химического элемента полостью определяются строением атома и молекулы водорода, то есть количеством энергетических уровней и распределением электронов на них.
Рождающий воду
Название элемента говорит о том, что соединение его атомов с частицами кислорода приводит к появлению такого уникального и важного для Земли вещества, как вода. В обычных условиях эта реакция не происходит, температура горения газовой смеси достигает 2800 °C. В лаборатории взаимодействие между H2 и O2 в соотношении 2:1 приводит к взрыву. Сама смесь получила название гремучего газа, а процесс, протекающий в ней, идет по свободно-радикальному механизму. Если его не контролировать, то реакция заканчивается серьезной проблемой – мощным взрывом. По этой причине, несмотря на его исключительную легкость, от водорода отказались как от наполнителя для воздушных летательных аппаратов. Печальным поводом послужило крушение в 1937 году дирижабля «Гинденбург», направлявшегося в Америку. Посмотрим теперь, как строение атома водорода влияет на физические признаки газа.

Водород, дейтерий, тритий
Пусть вас не удивляет приведенный выше перечень терминов. Речь идет все об одном и том же химическом элементе водороде, заряд ядра атома которого равен +1. Второе и третье названия – это имена изотопов. Причина их различий заключается в количестве нейтронов в ядре, тогда как протонное число всех трех видов частиц одинаково. У дейтерия два нейтрона, у трития – 3, сам же водород имеет 1 нейтрон в составе своего ядра. Вода, содержащая в составе своих молекул дейтерий, называется тяжелой. Ее можно обнаружить в прудах-охладителях атомных станций, а также в составе цитоплазмы клеток, имеющих нарушения нормального метаболизма.
Электронное строение атома водорода
Схема, приведенная ниже, поможет нам понять специфику поведения простого вещества H2 в различных химических взаимодействиях.
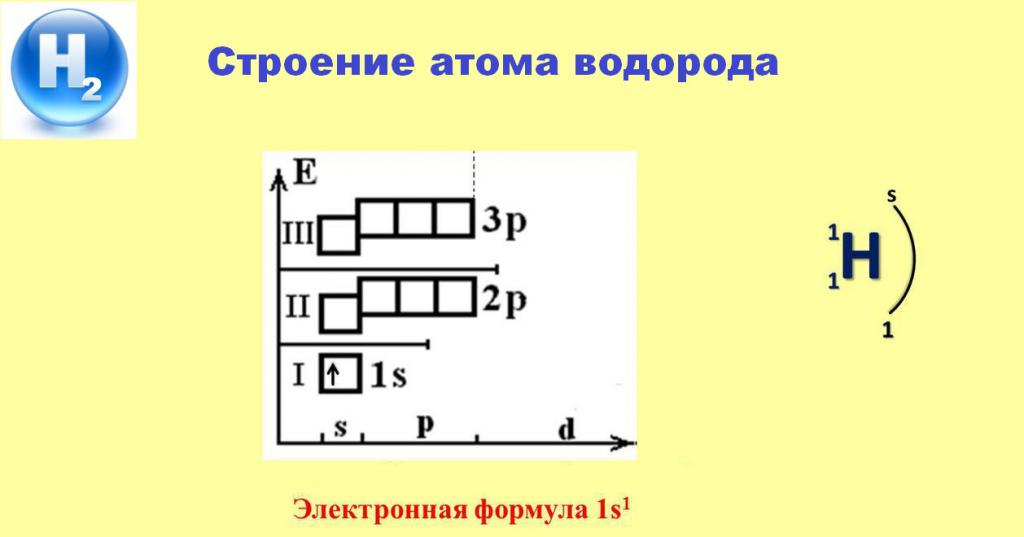
Наличие единственного электрона, занявшего s-орбиталь первого энергетического уровня, обеспечивает постоянную валентность водорода, равную 1. В большинстве случаев этот электрон покидает пространство атома и переходит во владение более электроотрицательных элементов. Лишь реакции с металлами позволяют водороду притянуть в сферу влияния собственного ядра электрон от атомов активных щелочных или щелочноземельных элементов, образуя белые кристаллические соединения — их гидриды.
Активный и агрессивный
Атомарный водород, так сказать, легок на подъем. Его быстроте в восстановлении металлов из их оксидов могут позавидовать другие восстановители вроде углерода или его окислов. Так же активно атомы H соединяются с частицами серы, кислорода, фосфора. А пламя горелки с атомарным водородом дает разогрев выше 4000 °C. По этой причине такими приборами легко обрабатывать поверхности металлов: резать или сваривать их.

Атомарный водород хорошо зарекомендовал себя в качестве восстановителя чистых металлов — вольфрама, молибдена — из их руд, представленных в основном оксидами. Встречаясь с такими же атомами, как и он сам, водород образует устойчивую и пассивную структуру – молекулу. Оба атома H держатся друг за друга с помощью общей электронной пары, являясь образцом стабильной ковалентной неполярной связи. Она прочная и обеспечивает устойчивость молекул H2 как в условиях земного существования, так и на просторах космоса. Не обошлась без водорода и пищевая промышленность, в которой его применяют для гидрогенизации масел и получения модных в современной диетологии низкокалорийных спредов.

В нашей статье мы рассмотрели, каково строение атома водорода, и выяснили, как оно влияет на свойства простого вещества
