Роль катализатора в химической реакции
Home / Публикации / Статьи / ТЕОРИЯ ХИМИЧЕСКИХ РЕАКЦИЙ / Роль катализатора в химической реакции
Существующее до сих пор определение катализатора (Катализаторами называют вещества, увеличивающие скорость реакции. Катализатор проводит реакцию по пути, требующему меньшей энергии активации) не объясняет явление, а только регистрирует внешнее событие. Наше определение помогает понять природу химических реакций и химической связи, физический смысл явления катализа.
Условно катализаторы можно разбить на две группы.
К первой группе относятся вещества, которые в условиях реакции дают значительно больше активных частиц ведущих цепной процесс. Наглядные примеры щелочной и кислотный гидролиз сложных эфиров.
Ко второй группе относятся катализаторы, увеличивающие концентрацию промежуточного соединения. Эти катализаторы образуют комплекс с обеими исходными насыщенными молекулами и электронная изомеризация протекает через промежуточное образование химических связей с катализатором.
AB + K → ABK
ABK + CD → ABKCD
ABKCD → AC + BD + K
где AB и CD являются реагирующими веществами.
Ускорение реакции (каталитическое действие вещества) может быть объяснено следующим образом. В отсутствии катализатора промежуточным соединением реакции является AB-CD, тогда как в присутствии катализатора — AB-K-CD. Скорость реакции в обоих случаях пропорциональна концентрации промежуточного соединения. Соотношение же между AB-CD (без катализатора) и AB-K-CD будет определяться энергией связи AB-CD и AB-K-CD.
Энергия связи обеих молекул с катализатором гораздо выше, чем их энергия связи друг с другом, поэтому концентрация промежуточных соединений с катализатором гораздо выше, следовательно, выше и скорость реакции.
Такой механизм действия катализатора типичен для биологических систем, в которых катализаторами обычно являются ферменты (энзимы), объединяющие вступающие в реакции молекулы в своих центрах.
Роль химической активации также возрастает с выигрышем энергии в ходе реакции, которая также идет на разрыв слабых связей, что позволяет понять физический смысл правил Семенова — Поляни.
Т.О., механизмы действия катализатора это :
- увеличение концентрации активных частиц в реакционной смеси;
- образование промежуточных соединений с обоими из реагентов реакции;
- химическая активация.
Как правило, в каталитической реакции присутствуют несколько механизмов.
Катализ и катализаторы — Энциклопедия wiki.MPlast.by
Катализ – это процесс изменения скорости химической реакции при помощи катализаторов – веществ, принимающих участие в химической реакции, но в состав конечных продуктов не входящих и в результате реакции не расходующихся.
Одни катализаторы ускоряют реакцию (положительный катализ), другие – замедляют (отрицательный катализ). Отрицательный катализ называют ингибированием, а катализаторы, понижающие скорость химической реакции – ингибиторами.
Различают гомогенный и гетерогенный катализ.
Гомогенный катализ.
При гомогенном (однородном) катализе реагирующие вещества и катализатор находятся в одинаковом агрегатном состоянии и между ними отсутствует поверхность раздела. Пример гомогенного катализа – реакция окисления SO2 и SO3 в присутствии катализатора NO (реагирующие вещества и катализатор являются газами).
Гетерогенный катализ.
В случае гетерогенного (неоднородного) катализа реагирующие вещества и катализатор находятся в различных агрегатных состояниях и между ними существует поверхность (граница) раздела. Обычно катализатор – твердое вещество, а реагирующие вещества – жидкости или газы. Пример гетерогенного катализа – окисление NN3 до NO в присутствии Pt (катализатор – твердое вещество).
Механизм действия катализаторов
Действие положительных катализаторов сводится к понижению энергии активации реакции Еа(исх), действие ингибиторов – противоположное.
Так, для реакции 2HI = H2+I2 Еа(исх)=184 кДж/моль. Когда же эта реакция протекает в присутствии катализатора Au или Pt, то Еа(исх)=104 кДж/моль, соответственно.
Механизм действия катализатора при гомогенном катализе объясняется образованием промежуточных соединений между катализатором и одним из реагирующих веществ. Далее промежуточное соединение реагирует со вторым исходным веществом, в результате чего образуется продукт реакции и катализатор в первоначальном виде. Так как скорость обоих промежуточных процессов значительно больше скорости прямого процесса, то реакция с участием катализатора протекает значительно быстрее, чем без него.
Например, реакция:
SO2 +1/2 O2 = SO3 протекает очень медленно, а если использовать катализатор NO
то реакции NO +1/2О2 = NO2 и NO2 +SO2 = SO3 +NO протекают быстро.
Механизм действия катализатора при гетерогенном катализе иной. В этом случае реакция протекает вследствие адсорбции молекул реагирующих веществ поверхностью катализатора (поверхность катализатора неоднородна: на ней имеются так называемые активные центры, на которых и адсорбируются частицы реагирующих веществ.). Увеличение скорости химической реакции достигается, в основном, за счет понижения энергии активации адсорбированных молекул, а также, отчасти, за счет увеличения концентрации реагирующих веществ в местах, где произошла адсорбция.
Каталитические яды и промоторы.
Некоторые вещества снижают или полностью уничтожают активность катализатора, такие вещества называют каталитическими ядами. Например, небольшие примеси серы (0,1%) полностью прекращает каталитическое действие металлического катализатора (губчатого железа), использующегося при синтезе аммиака. Вещества, повышающие активность катализатора, называют промоторами. Например, каталитическая активность губчатого железа значительно возрастает при добавлении примерно 2% метаалюмината калия
Применение катализаторов
Действие катализатора избирательно и специфично. Это означает, что, применяя различные катализаторы, из одних и тех же веществ можно получить различные продукты. Это особенно характерно для реакций органических веществ. Например, в присутствии катализатора AlO3 происходит дегидратация этилового спирта, в присутствии Cu – дегидрирование: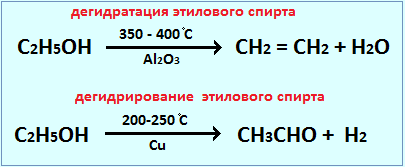
Биологические катализаторы, принимающие участие в сложных химических превращениях, протекающих в организме, называются ферментами.
Катализаторы широко используются в производстве серной кислоты, аммиака, каучука, пластмасс и др. веществ.
Автор: Метельский А.В
Источник: Метельский А.В., Химия в Экзаменационных вопросах и ответах, Минск, изд. «Беларуская энцыклапедыя», 1999 год
Ферменты — биологические катализаторы
- ГДЗ
- 1 Класс
- Окружающий мир
- 2 Класс
- Литература
- Окружающий мир
- 3 Класс
- Окружающий мир
- 4 Класс
- Окружающий мир
- 5 Класс
- Биология
- История
- География
- Литература
- Обществознание
- Человек и мир
- Технология
- Естествознание
- Биология
- История
- География
- Литература
- Обществознание
- Технология
- 7 Класс
- Биология
- История
- ОБЖ
- География
- Литература
- Обществознание
- 8 Класс
- Биология
- История
- География
- Литература
- Обществознание
- 9 Класс
- Биология
- История
- География
- Литература
- Обществознание
- 10 Класс
- Биология
- История
Катализаторы — это… Что такое Катализаторы?
Катализа́тор — вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции (Химическая энциклопедия). Количество катализатора, в отличие от других реагентов, при реакции не изменяется. Обеспечивая более быстрый путь для реакции, катализатор реагирует с исходным веществом, получившееся промежуточное соединение подвергается превращениям и в конце расщепляется на продукт и катализатор. Затем катализатор снова реагирует с исходным веществом, и этот каталитический цикл многократно (сотни, миллионы раз) повторяется.
Катализаторы в химии
Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный – образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества (Химическая энциклопедия). Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Реакции одного и того же типа могут протекать как с гомогенными, так и с гетерогенными катализаторами. Так, наряду с растворами кислот применяются имеющие кислотные свойства твёрдые Al2O3, TiO2, ThO2, алюмосиликаты, цеолиты. Гетерогенные катализаторы с основными свойствами: CaO, BaO, MgO (Химическая энциклопедия).
Гетерогенные катализаторы имеют, как правило, сильно развитую поверхность, для чего их распределяют на инертном носителе (силикагель, оксид алюминия, активированный уголь и др.).
Для каждого типа реакций эффективны только определённые катализаторы. Кроме уже упомянутых кислотно-основных, существуют катализаторы окисления-востановления; для них характерно присутствие переходного металла или его соединения (Со+3, V2O5+MoO3). В этом случае катализ осуществляется путём изменения степени окисления переходного металла.
Много реакций осуществлено при помощи катализаторов, которые действуют через координацию реагентов у атома или иона переходного металла (Ti, Rh, Ni). Такой катализ называется координационным.
Если катализатор обладает хиральными свойствами, то из оптически неактивного субстрата получается оптически активный продукт.
В современной науке и технике часто применяют системы из нескольких катализаторов, каждый из которых ускоряет разные стадии реакции (Имянитов, Temkin). Катализатор также может увеличивать скорость одной из стадий каталитического цикла, осуществляемого другим катализатором. Здесь имеет место «катализ катализа», или катализ второго уровня (Имянитов).
В биохимических реакциях роль катализаторов играют ферменты.
Катализаторы следует отличать от инициаторов. Например, перекиси распадаются на свободные радикалы, которые могут инициировать радикальные цепные реакции. Инициаторы расходуются в процессе реакции, поэтому их нельзя считать катализаторами.
Ингибиторы иногда ошибочно считают отрицательными катализаторами. Но ингибиторы, например, цепных радикальных реакций, реагируют со свободными радикалами и, в отличие от катализаторов, не сохраняются. Другие ингибиторы (каталитические яды) связываются с катализатором и его дезактивируют, здесь имеет место подавление катализа, а не отрицательный катализ. Отрицательный катализ в принципе невозможен: он обеспечивал бы для реакции более медленный путь, но реакция, естественно, пойдёт по более быстрому, в данном случае, не катализированному, пути.
Катализаторы в автомобилях
На дороги ежедневно выезжают миллионы автомобилей, и каждый из них — источник загрязнения воздуха. Особенно это чувствуется в крупных городах, где выхлопные газы автомобилей могут создавать большие проблемы.
В современных автомашинах присутствует каталитический преобразователь или автомобильный катализатор. Задачей автомобильного катализатора является снижение количества вредных веществ в выхлопных газах. Среди них:
- окись углерода (СО) — ядовитый газ без цвета и запаха
- углеводороды, также известные как летучие органические соединения — один из главных компонентов смога, образуется за счет неполного сгорания топлива
- оксиды азота (NO и NO2, которые часто объединяют под обозначением NOx) — также являются компонентом смога, а также кислотных дождей, оказывают влияние на слизистую человека.[1]
Источники
- ↑ Автомобильный катализатор и его роль в выхлопной системе. AutoRelease.ru.
Литература
- Химическая энциклопедия. — М.: Советская энциклопедия, 1990. — Т. 2. — С. 335, 337. — ISBN 5-85270-035-5.
- Имянитов Н. С. Системы из нескольких катализаторов в металлокомплексном катализе. // Координационная химия. 1984. — Т. 10. — № 11 — С. 1443 — 1454. — 0132-344X.
- Temkin O.N., Braylovskiy S. M. / The mechanism of catalysis in homogeneous polyfunctional catalytic systems. // Fundamental Research in Homogeneous Catalysis. — Ed. by A.E. Shilov. — New York etc: Gordon and Breach Science Publishers, 1986. — Vol. Two. — P.621- 633.
Ссылки
См. также
Wikimedia Foundation. 2010.
помогите пожалуйста с задачей по химии!5 (8 класс)
Каталитических реакций огромное количество. И катализаторы выполняют разные функции. Они могут ускорять химический процесс или замедлять (в этом случае их называют ингибиторами) . Катализаторы работают по-разному. Один из наиболее распространенных и многотоннажных процессов — каталитический крекинг нефтепродуктов: получение из нефтяного сырья углеводородов обычно бензиновой фракции: из более ттяжелых — более легких. Но здесь писать по этому поводу — оченнь много. В интернете МАССА материалов по этой теме.
Катализатор насколько я помню, это ускорение какого-либо химического процесса, реакции и т. д. А пример привести не могу попробуй поискать в интернете
Горение метана характеризуется реакцией СН4 + 202 = 2Н20 + С02, т. е. одна молекула метана соединяется с двумя молекулами кислорода и образует две молекулы водяных паров и одну молекулу углекислого газа. При неполном сгорании метана реакции протекают иначе Перепутала вопросы. извини.
Катализаторы ускоряют ход химической реакции t 2 КСIО3——2КСI + 3О2 — реакция получения кислорода из бертолетовой соли, где MnО2 катализатором слухит оксид марганца
«Катализаторы» сообщение кратко | Kratkoe.com


Роль катализаторов в современном производстве сообщение кратко расскажет много полезной информации о них и поможет подготовиться к занятию.
«Катализаторы» сообщение кратко
Что такое катализатор?
Катализаторы представляют собой вещества, способные ускорять химические реакции некоторых продуктов и не входят в их состав. Существуют также и биологические катализаторы – ферменты, ускоряющие химические реакции в живых организмах.
Например, пероксид водорода, попав на ранку или царапину, начинает сильно шипеть и пузыриться. Это и есть действие катализатора. В момент выделения, кислород оказывает дезинфицирующие свойства — из ранки вместе с пеной удаляются загрязнения. Шипение происходит потому, что в крови содержатся вещества, ускоряющие разложение пероксида водорода.
Кто ввел термин «катализатор»?
Шведский химик И. Берцелиус в 1835 году выявил, что в присутствии некоторых веществ скорость определенных химических реакций возрастает в разы. Он ввел термин «катализатор», от греческого «katalysis» — «разрушение», «ослабление».
Какая роль катализаторов?
В жизни человека катализаторы очень играют важную роль. Ферменты применяют с давних времен в сыроварении, хлебопечении, кожевничестве, пивоварении, виноделии.
Сегодня катализаторы активно применяются в промышленности – при получении белков, синтетических антибиотиков и переработке сахара. Так, в моющих средствах добавляются ферменты, ускоряющие расщепление белковых загрязнений; универсальные порошки для удаления пятен, пищевых продуктов, пота, крови содержат в себе ферментные «энзимы».
Без катализаторов невозможно превратить в маргарин растительное масло, изготовить кулинарный жир, другие пищевые продукты. С их помощью очищают газообразные отходы промышленных предприятий и удаляют разнообразные токсичные соединения, выхлопные газы.
В ХХ веке ученые научились при помощи каталитических методов получать органические материалы, нитрилы, эфиры, олефины, кислоты для производства пластмасс, пропан, стирол, бутан, бутен.
Промышленные кислотные катализаторы незаменимы при нефтепереработке, для получения ароматических углеводородов и парафинов. Новейшей технологией по их применению является технология получения высокооктановых видов бензина, а также этилированного топлива.
Надеемся, что сообщение о роли катализаторов помогло Вам подготовиться к занятию, и Вы узнали много полезной информации о них. А свое краткое сообщение о катализаторах Вы можете оставить через форму комментариев ниже.
Понятие о катализаторе | Химия. Шпаргалка, шпора, формула, закон, ГДЗ, опыты, тесты, сообщение, реферат, кратко, конспект, книга
Попав на царапину или ранку, пероксид водорода разлагается намного интенсивнее (сильно пузырится, «шипит»). Кислород в момент выделения обладает сильными дезинфицирующими свойствами. Вместе с пеной из ранки удаляется загрязнение. Это происходит потому, что кровь содержит особые вещества, которые ускоряют разложение пероксида водорода. В 1835 г. шведский химик И. Берцелиус установил, что в присутствии определенных веществ скорость некоторых химических реакций существенно возрастает. Для таких веществ он ввел термин «катализатор» (греч. katalysis — «ослабление», «разрушение»).
Катализаторы — вещества, которые ускоряют химические реакции, но не входят в состав их продуктов.
Ферменты — биологические катализаторы, они ускоряют химические реакции в живых организмах.
Разложение пероксида водорода могут ускорять многие вещества. Среди них — оксид марганца (IV) — один из продуктов разложения перманганата калия. Щепотка этого соединения ускоряет разложение все новых и новых порций пероксида водорода. Сам оксид марганца (IV) при этом не расходуется и не входит в состав продуктов реакции (рис. 18.6).
| Рис. 18.5. Схема получения кислорода разложением пероксида водорода и собирания кислорода вытеснением воздуха |
| Рис. 18.6. Каталитическое разложение пероксида водорода |
Кислород немного тяжелее воздуха. Поэтому его можно собрать вытеснением воздуха в сосуд, размещенный отверстием вверх (рис. 18.5).
Катализаторы играют важную роль в жизни человека. Ферменты принимают участие в регуляции биохимических процессов. С давних времен ферментативные процессы применяют в хлебопечении, сыроварении, виноделии, пивоварении, кожевничестве и т. п.
И сейчас ферменты применяют в промышленности: при переработке сахара, получении синтетических антибиотиков и белков. В моющие средства добавляют ферменты, которые ускоряют расщепление загрязнений белковой природы. Универсальные стиральные порошки для эффективного удаления пятен от пота, крови, пищевых продуктов и других белковых загрязнений содержат биодобавки и ферменты (их еще называют «энзимы»). Материал с сайта http://worldofschool.ru
| Рис. 18.7. Изготовление сыра невозможно без применения ферментов |
| Рис. 18.8. Схема очистки автомобильных выхлопных газов |
Важная черта современной практической химии — осуществление процессов с использованием катализаторов. Без них, например, невозможно превратить растительное масло в маргарин.
Каталитические методы очищения газообразных отходов промышленных предприятий применяют для удаления разнообразных токсичных соединений.
Также катализаторы нужны для очистки автомобильных выхлопных газов (рис. 18.8).
На этой странице материал по темам:Оціни значення каталізаторів у житті людини
Наблюдение и эксперименты химии
Значение катализаторов в жизни человека
Хто увів поняття про каталізатори
Реферат на тему катализаторы,понятие,их роль в жизни человека
Назови вещества, в которые превращаются составляющие автомобильных выхлопных газов после каталитической очистки.
Есть ли среди продуктов каталитической очистки выхлопных газов ядовитые вещества?
Оцени значение катализаторов в жизни человека.
