Газ ксенон — где применяется и как его добывают
В настоящее время инертные газы получили широкое распространение в самых различных сферах человеческой жизни. Не является исключением и газ ксенон – один из самых необычных химических элементов, известных науке. Он представляет собой так называемый благородный газ, состоящий из молекул с одним атомом, который не обладает каким-либо запахом, вкусом или цветом. Кроме того, он не горит, не приводим к взрывам и является относительно безопасным для человека.
В природе этот химический элемент представлен в крайне малых количествах. Очень незначительные запасы такого вещества сосредоточены в земной коре и атмосфере нашей планеты. Кроме того, как известно современным ученым, он занимает невысокие позиции по своей распространенности и в космосе. Возможно, именно по этой причине этот элемент долгое время оставался неизвестным науке и был открыт лишь в конце 19-го века.
Ключевой особенностью газа ксенона, которая отличает его от многих других инертных газов, является его способность вступать в химические реакции с образованием ковалентных связей. Это первый благородных газ, с помощью которого удалось получить химические соединения, например, такие как дифторид ксенона. Кроме того, он обладает и другими особенностями, которые позволяют применять его в самых различных направлениях деятельности.
Использование в источниках света
Различные виды ламп создаются с применением газообразных веществ, которые позволяют создать внутри такого изделия соответствующие условия. При создании источников света применяется и ксенон. Им наполняют некоторые виды ламп накаливания, а также высокомощные импульсные и газоразрядные лампы. Некоторые из них способны создавать по-настоящему мощное свечение, так как окруженная Xe электрическая дуга создает очень яркий свет.
Очень часто лампы с Xe применяются при создании кинопроекторов, а также софитов для концертного и театрального оборудования. Это вещество все чаще используется в качестве аналога ртути в лампах, предназначением которых является получение ультрафиолета. Еще одно его свойство заключается в том, что из-за высокой атомной массы он препятствует испарению вольфрама с поверхности нити накаливания (находясь внутри колбы лампы).
Применение в области медицины
В конце 20-го века впервые были проведены испытания медицинского ксенона, которые показали, что он является безопасным и эффективным средством для наркоза и обезболивания. Это связано с тем, что при правильной концентрации такой газ является полностью безопасным для человека. Он не вступает в какие-либо химические реакции и быстро выводится из организма.
В наркозе ксенон обладает опьяняющим эффектом, аналогичным тому, который возникает при использовании так «веселящего газа» – закиси азота. Об этом стало известно еще задолго до того, как Xe начал применяться в области медицины. В последствии многочисленные исследования показали, что данный газ представляет собой идеальное вещество для наркоза.
В настоящее время его активно применяют в различных странах мира. Например, с конца 90-х годов он официально разрешен для использования в качестве анестезии на территории Российской Федерации, а в середине 2000-х годов получил разрешение и в странах-членах Европейского Союза. Если вас интересует возможность применения газов и их смесей в медицине, то предлагаем вам прочесть отдельную статью, посвященную этой теме.
Как газ ксенон применяется в сфере покорения космоса?
Обладая самой высокой стабильностью среди других тяжелых инертных газов, этот химический элемент применяется в качестве рабочего тела в:
- ионных реактивных двигателях;
- плазменных реактивных двигателях.
Для этих целей его используют преимущественно в чистом виде. При этом очищенные от различных посторонних добавок благородные газы могут обладать достаточно высокой стоимостью. Узнать с чем это связано вы можете в нашем материале, посвященном теме глубокой очистки газов.
Ионные и плазменные реактивные двигатели в настоящее время используются в современных и высокомощных космических кораблях, основным назначением которых является изучение планет Солнечной системы.
Кроме того, вас может заинтересовать и другой инертный газ – криптон, прочесть о применении которого вы можете здесь.
В чем заключается сложность получения ксенона?
Во-первых, в атмосфере Земли этот элемент является очень редким, поэтому его добыча в чистом виде невозможна. Во-вторых, технология его получения очень сложная и дорогостоящая. Его добывают как побочный продукт в процессе производства жидкого кислорода, а также при искусственном разделении воздуха на кислород и азот. Ученые ищут новые способы получения Xe, которые были бы более эффективными и безопасными в плане экологии.
Выводы
Xe – это инертный тяжелый газ, который обладает особыми качествами и широко применяется в различных сферах жизни, в том числе в медицине, науке и технике. Единственная сложность заключается в трудоемком процессе его получения, а, следовательно, высокой стоимости.
Также, если вас интересуют другие технические газы, вы можете изучить каталог продукции на сайте компании «ПРОМТЕХГАЗ» по ссылке http://www.propangaz.ru/.
Применение ксенона
Без ксенона — тяжелого, редкого и пассивного газа сегодня не могут обойтись многие отрасли народного хозяйства. Области его применения разнообразны и порой неожиданны.
В светотехнике признание получили ксеноновые лампы высокого давления. В таких лампах светит дуговой разряд в ксеноне, находящемся под давлением в несколько десятков атмосфер. Свет в ксеноновых лампах появляется сразу после включения, он ярок и имеет непрерывный спектр — от ультрафиолетового до ближней области инфракрасного.
Цвет его близок к белому с чуть желтоватым оттенком; на него можно смотреть только через фильтр: глаза не выдерживают таких ярких лучей.
Ксеноновые лампы применяются во всех случаях, когда правильная цветопередача имеет решающее значение: при киносъемках и кинопроекции, при освещении сцены и телевизионных студий, в текстильной и лакокрасочной промышленности.
Коллектив Московского электролампового завода создал уникальное осветительное устройство — ксеноновый светильник «Сириус». В лампе используется непрерывный электрический разряд в сосуде из кварцевого стекла, наполненном ксеноном под высоким давлением. Между двойными стенками сосуда циркулирует охлаждающая его вода. Мощность лампы «Сириус» 300 киловатт. Одна такая лампа способна осветить большую городскую площадь. Это, пожалуй, самая мощная лампа в мире.
Промышленность начинает применять фториды ксенона, прежде всего моноизотопные. Изотопы ксенон-133 и особенно ксенон-135 имеют очень большие сечения захвата тепловых нейтронов, это сильные реакторные яды. Но после получения твердых и достаточно стойких соединений элемента № 54 появилась надежда использовать это свойство изотопов ксенона на благо ядерной физики. С другой стороны, возможность связать эти изотопы фтором позволяет решить и технически, и экологически важную задачу эффективного улавливания этих изотопов. А еще: в виде фторидов ксенона удобно хранить и транспортировать и дефицитный ксенон, и всеразрушающий фтор.
Окислительные свойства соединений ксенона, прежде всего того же дифторида, уже широко используют в лабораторной практике и несколько уже — при синтезе новых практически важных веществ. В частности, с помощью соединений ксенона получают некоторые медицинские препараты, например 5-фторурацил. Но, как говорится, это только цветочки — ягодки впереди. Как и другие новые области науки, химия благородных газов, в первую очередь ксенона, развивается очень быстрыми темпами. Скоро никого уже не удивит, например, реактивный двигатель с ксенонсодержащим окислителем.
Соединения элемента № 54 коренным образом преобразили его судьбу.
- КЛАТРАТНЫЕ СОЕДИНЕНИЯ. В 1896 г. было сделано открытие, долгое время казавшееся абсурдным. Вайяр сообщил, что им синтезирован гидрат аргона Аг-6Н20. Почти 30 лет не удавалось получить аналогичных соединений других инертных газов. Лишь в 1925 г. Форкан обнаружил, что при взаимодействии ксенона со льдом под давлением образуется гидрат ксенона Хе-6Н20. В 1940 г. известный советский химик Б. А. Никитип при кристаллизации фенола под давлением 40 атм в присутствии ксенона получил соединение Хе-ЗС6Н5ОН. Все эти соединения — клатратные (или соединения включения). В них нет химической связи. Процесс их образования сводится к внедрению «чужих» молекул в полости, которые уже существуют или могут возникнуть при определенных условиях в кристаллической решетке того или иного вещества. Нужно только, чтобы совпадали размеры пустот и размеры «внедряемых» атомов.
- В ЦИКЛОТРОННОМ ТАНДЕМЕ. Сейчас физикам уже очевидно, что получать элементы далекой трансурановой области можно только в ядерных реакциях с участием тяжелых ионов, причем чем тяжелее будут ускоряемые частицы, тем тяжелее окажется и составное ядро. И пусть оно будет жить неизмеримо малое время; образование ядер новых элементов возможно не только в результате реакции слияния, но и распада! При распаде сверхтяжелых ядер могут образовываться и сверхтяжелые осколки — тоже новые ядра. И возможно — ядра атомов гипотетической пока области относительной стабильности в районе элементов с атомными номерами 114 и 126. Интерес представляет такая, к примеру, реакция:
23892U +12954Хе → 67146.
Ученые надеются, что среди осколков деления такого ядра будут ядра элемента № 114 с 184 нейтронами, а они, по расчетам теоретиков, должны жить достаточно долго.
Опыты по ускорению тяжелых ионов ксенона начались в Дубне, в Объединенном институте ядерных исследований, в 1971 г.
- ИЗОТОПЫ. Обычный природный ксенон состоит из 9 изотопов, массовые числа которых — 124, 126, 128, 129, 130, 131, 132, 134 и 136. В 1946 г. советский ученый В. Г. Хлопин с сотрудниками впервые установил присутствие ксенона в осколках, образующихся при спонтанном делении урана. Среди продуктов такого деления ксенона много —19% общей суммы осколков. Радиогенный ксенон образуется не только из самого урана, но и из некоторых продуктов его деления. Например, в ксенон превращается радиогенный теллур — путем двойного бета-перехода. А при нейтронном захвате бета-активные изотопы теллура превращаются сначала в йод, а затем — в ксенон.
Радиоактивные изотопы ксенона тоже многочисленны. Их массовые числа — от 113 до 145, а период полураспада самого долгоживущего — ксенона-127 — 34,4 суток.
- В МЕТАЛЛИЧЕСКОМ СОСТОЯНИИ. Под действием высокого давления замороженный ксенон способен переходить в металлическое состояние. Впервые это удалось сделать в начале 1979 г. группе сотрудников Института физики высоких давлений Академии наук СССР на той же установке, на которой четырьмя годами раньше был получен металлический водород. Почти одновременно об открытии металлического ксенона сообщили американские исследователи. Металлический ксенон, дополнительно охлажденный жидким гелием, оказался сверхпроводником. Сверхпроводящие свойства он сохранял до температуры 6,8±0,1 ºК.
- ЕСТЬ И ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ. Сообщения о новых соединениях ксенона в наши дни появляются регулярно. И немногие из этих соединений становятся популярными даже среди химиков. Исключение составили, пожалуй, лишь впервые полученные в 1975 г. соединения, в которых есть связь ксенон — азот, да ксенонорганические соединения, такое, например: CF3— Xe—CF3. Его получили в реакции гексафторэтана с дифторидом ксенона.
Ксенон и его воздействие на организм
Ксенон — редчайший газ земной атмосферы, содержание в воздухе 8,6•10-5% по объему. Общие запасы ксенона в атмосфере 1,6•1011м3. Ксенон выделяют как побочный продукт при переработке воздуха на азот и кислород.
Физические свойства ксенона
Ксенон — одноатомный газ без цвета и запаха. В 100 мл воды при 20°C растворяется 9,7 мл Xe. Ксенон образует клатраты с водой и многими органическими веществами: Хе•5,75Н2О, 4Хе•3С6Н5ОН и другие. В клатратах атомы-гости Xe занимают полости в кристаллических решетках веществ-хозяев.
Химические свойства ксенона
Первый «инертный газ», для которого были получены настоящие химические соединения.
Непосредственно Xe взаимодействует только со фтором, образуя XeF2, XeF4 и XeF6. Дифторид ксенона XeF2 имеет тетрагональную решетку, температуру плавления 129°C, плотность 4,32 г/см3. Решетка тетрафторида XeF4 моноклинная, температура плавления 117,1°C, плотность 4,0 г/см3. Решетка гексафторида XeF6 моноклинная, температура плавления 49,5°C, плотность 3,41 г/см3.
Гидролизом XeF4 и XeF6 получают неустойчивые оксифториды XeОF
Применение ксенона
Несмотря на высокую стоимость, ксенон незаменим в ряде случаев:
- Ксенон используют для наполнения ламп накаливания, мощных газоразрядных и импульсных источников света (высокая атомная масса газа в колбах ламп препятствует уносу вольфрама с поверхности нити накаливания).
- Радиоактивные изотопы (127Xe, 133Xe, 137Xe, и др.) применяют в качестве источников излучения в радиографии и для диагностики в медицине, для обнаружения течи в вакуумных установках.
- Фториды ксенона используют для пассивации металлов.
- Ксенон как в чистом виде, так и с небольшой добавкой паров цезия-133, является высокоэффективным рабочим телом для электрореактивных (главным образом — ионных и плазменных) двигателей космических аппаратов.
- С конца ХХ века ксенон стал применяться, как средство для общего наркоза (достаточно дорогой, но практически нетоксичный, точнее — не вызывает химических последствий — как инертный газ). Первые диссертации о технике ксенонового наркоза в России — 1993 г (…).
- Жидкий ксенон иногда используется как рабочая среда лазеров огромной мощности.
- Фториды и оксиды ксенона предложены в качестве мощнейших окислителей ракетного топлива, а так же в качестве компонентов газовых смесей, применяемых в боевых лазерах огромной мощности(как наземных для противовоздушной обороны так и для лазеров космического базирования).
Ксенон сегодня широко применяется в разных отраслях медицины, поскольку использование этого газа позволяет эффективно бороться со многими заболеваниями, а также оказывает на организм профилактическое действие. Ксеноновые ингаляции обладают рядом преимуществ перед проведением процедуры с использованием лекарственных препаратов. Прежде всего, — это отсутствие аллергических реакций и возникновение побочных явлений, что дает возможность проводить терапию даже при лечении беременных женщин.
Воздействие ингалянций ксенона на организм
Ксенон повышает умственные способности организма, поэтому они особенно показаны для тех людей, чья работа связана с умственной деятельностью и стрессовыми ситуациями. Кроме того, ксеноновые ингаляции снимают усталость, нервное перенапряжение, способствуют эмоциональному подъему. Именно поэтому обычно такие процедуры являются обязательной частью восстановительной терапии.
Возможным становится применение ксенона в хирургии и стоматологии для погружения пациента в сон, после чего наступает быстрое и легкое пробуждение без возможных осложнений в отличие от других медицинских препаратов. Ксенон оказывает на человеческий организм ярко выраженный противовоспалительный, обезболивающий и успокоительный эффект.
Не стоит опасаться вредного воздействия ксенона, поскольку он является абсолютно нетоксичным препаратом, не повреждая клетки и ткани, а также, не затрагивая центральную нервную систему. Ингаляции официально разрешены к применению при подготовке спортсменов, так как они эффективно повышают физические способности, не являясь при этом допингом.
Особенности проведения процедуры ксеноном
Ксеноновые ингаляции обязательно должны проводиться в спокойной обстановке, способствующей расслаблению пациента. Именно поэтому важно, чтобы в помещении было мягкое освещение, несколько отдельных палат, спокойная музыка, а также предварительная беседа с врачом – все это настроит человека на получение максимального эффекта от лечебной процедуры.
Процедура ингаляции с использованием ксенона обычно длиться полчаса. При этом газ поступает в организм в течение не более 3 минут, оказывая на него мягкое терапевтическое действие. Эффект после проведенной процедуры может длиться до 5 суток, но, чтобы достичь ожидаемого результата, необходимо провести 3-5 сеансов.
Используемый медицинский газ не вызывает у пациента физической или психической зависимости, он очень быстро выводится из организма, не имея свойства в нем накапливаться. При этом быстрое выведение ксенона не влияет на продолжительность восстанавливающего и лечебного действия препарата.
Противопоказания для проведения процедуры ксеноном
Несмотря на положительные свойства, которыми обладает ксенон, все же существуют определенные противопоказания к проведению процедуры. Именно поэтому назначать, а тем более проводить ксеноновые ингаляции, должен исключительно специалист. Стоит отказаться от проведения терапии при инфаркте миокарда, пневмотораксе, стенокардии, выраженной недостаточности кровообращения, пороках сердца – как врожденных, так и приобретенных, эпилепсии, дыхательной недостаточности, шизофрении, протекании острых инфекционных заболеваний.
Как видно, ксеноновые ингаляции противопоказаны только при критических состояниях, которые требуют госпитализации пациента.
Физиологическое действие ксенона
- Газ ксенон безвреден, но способен вызвать наркоз (по физическому механизму), а в больших концентрациях вызывает асфиксию.
- Фториды ксенона ядовиты, ПДК в воздухе 0,05 мг/м3.
Читайте также:
Оцените статью:
[Всего голосов: 2 Средний: 5/5]Ксенон
| Ксенон | |
|---|---|
| Атомный номер | 54 |
| Внешний вид простого вещества | инертный газ без цвета, вкуса и запаха |
| Свойства атома | |
|
Атомная масса (молярная масса) |
131,29 а. е. м. (г/моль) |
| Радиус атома | ? (108) пм |
|
Энергия ионизации (первый электрон) |
1 170,0 (12,13) кДж/моль (эВ) |
| Электронная конфигурация | [Kr] 4d10 5s2 5p6 |
| Химические свойства | |
| Ковалентный радиус | 140[1]пм |
| Радиус иона | 190 пм |
|
Электроотрицательность (по Полингу) |
2,6 |
| Электродный потенциал | 0 |
| Степени окисления | 0, +1, +2, +4, +6, +8 |
| Термодинамические свойства простого вещества | |
| Плотность | 3,52 (при −109 °C) г/см³ |
| Молярная теплоёмкость | 20,79 Дж/(K·моль) |
| Теплопроводность | 0,0057 Вт/(м·K) |
| Температура плавления | 161,3 K |
| Теплота плавления | 2,27 кДж/моль |
| Температура кипения | 166,1 K |
| Теплота испарения | 12,65 кДж/моль |
| Молярный объём | 42,9 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки |
кубическая гранецентрированая |
| Параметры решётки | 6,200 Å |
| Отношение c/a | — |
| Температура Дебая | n/a K |
| Xe | 54 |
| 131,29 | |
| [Kr]4d105s25p6 | |
| Ксенон | |
Ксенон — элемент главной подгруппы восьмой группы, пятого периода периодической системы химических элементов, с атомным номером 54. Обозначается символом Xe (Xenon). Простое вещество ксенон (CAS-номер: 7440-63-3) — инертный одноатомный газ без цвета, вкуса и запаха. Открыт в 1898 году английскими учеными У.Рамзаем и У. Рэлей как небольшая примесь к криптону.
Происхождение названия
ξένος — чужой.
Распространённость
Ксенон относительно редок в атмосфере Солнца, на Земле, в составе астероидов и комет. Концентрация ксенона в атмосфере Марса аналогична земной: 0.08 миллионной доли, хотя содержание 129Xe на Марсе выше, чем на Земле или Солнце. Поскольку данный изотоп образуется в процессе радиоактивного распада, полученные данные могут свидетельствовать о потере Марсом первичной атмосферы, возможно, в течение первых 100 миллионов лет после формирования планеты. У Юпитера, напротив, необычно высокая концентрация ксенона в атмосфере — почти в два раза выше, чем у Солнца.
Земная кора
Ксенон находится в земной атмосфере в крайне незначительных количествах, 0.087±0.001 миллионной доли (μL/L), а также встречается в газах, испускаемых некоторыми минеральными источниками. Некоторые радиоактивные изотопы ксенона, например, 133Xe и 135Xe, получаются как результат нейтронного облучения ядерного топлива в реакторах.
Определение
Качественно ксенон обнаруживают с помощью эмиссионной спектроскопии (характеристические линии 467,13 нм и 462,43 нм). Количественно его определяют масс-спектрометрически, хроматографически, а также методами абсорбционного анализа.
Физические свойства
Температура плавления −112 °C,температура кипения −108 °C,свечение в разряде фиолетовым цветом.
Химические свойства
Первый инертный газ, для которого были получены настоящие химические соединения. Примерами соединений могут быть дифторид ксенона, тетрафторид ксенона, гексафторид ксенона, триоксид ксенона.
Изотопы ксенона
Получение
Ксенон получают как побочный продукт производства жидкого кислорода на металлургических предприятиях.
В промышленности ксенон получают как побочный продукт разделения воздуха на кислород и азот. После такого разделения, которое обычно проводится методом ректификации, получившийся жидкий кислород содержит небольшие количества криптона и ксенона. Дальнейшая ректификация обогащает жидкий кислород до содержания 0.1-0.2 % криптоноксеноновой смеси, которая отделяется адсорбированием на силикагель или дистилляцией. В заключение, ксеноно-криптоновый концентрат может быть разделен дистилляцией на криптон и ксенон. Из-за своей малой распространенности, ксенон гораздо дороже более легких инертных газов.
Применение
Ксеноновая лампа Прототип ионного двигателя на ксеноне.Несмотря на высокую стоимость, ксенон незаменим в ряде случаев:
- Ксенон используют для наполнения ламп накаливания, мощных газоразрядных и импульсных источников света (высокая атомная масса газа в колбах ламп препятствует испарению вольфрама с поверхности нити накаливания).
- Радиоактивные изотопы (127Xe, 133Xe, 137Xe, и др.) применяют в качестве источников излучения в радиографии и для диагностики в медицине, для обнаружения течи в вакуумных установках.
- С конца XX века ксенон стал применяться как средство для общего наркоза (достаточно дорогой, но абсолютно нетоксичный, точнее — как инертный газ — не вызывает химических последствий). Первые диссертации о технике ксенонового наркоза в России — 1993 г., в качестве лечебного наркоза эффективно применяется для снятия острых абстинентных состояний (Абстинентный синдром) и лечения наркомании, а также психических и соматических расстройств.
- Жидкий ксенон иногда используется как рабочая среда лазеров
- Фториды и оксиды ксенона предложены в качестве мощнейших окислителей ракетного топлива, а так же в качестве компонентов газовых смесей для лазеров.
- В изотопе 129Xe возможно поляризовать значительную часть ядерных спинов для создания состояния с сонаправленными спинами — состояния называемого гиперполяризацией.
- Ксенон используется в конструкции ячейки Голея.
Биологическая роль
Ксенон не играет никакой биологической роли.
Физиологическое действие
Газ ксенон безвреден, но способен вызвать наркоз (по физическому механизму), а в больших концентрациях (более 80 %) вызывает асфиксию.
Фториды ксенона ядовиты, ПДК в воздухе 0,05 мг/м³.
Благородный газ, который можно использовать вместо наркотика
Федор Григорьев, кандидат химических наук
Токсичность вещества для наркоза определяется прежде всего его способностью вступать в химические реакции. Если она велика, то наркотическое вещество влияет на метаболизм, что может негативно сказаться на здоровье пациента. Какие элементы наименее склонны участвовать в реакциях? Это известно из школьного курса химии — инертные, или благородные газы.
Наркотическое столетие
У инертных газов целиком заполнены электронные оболочки, и поэтому эти газы, как правило, не образуют химических связей. Можно ожидать, что и при попадании в организм благородные газы будут слабо или вовсе не участвовать в метаболизме.
С этой точки зрения идея использования благородных газов для ингаляционной анестезии выглядит очень перспективно. Символично, что доклад об анестезирующих свойствах ксенона первооткрыватель этих свойств, профессор-токсиколог Николай Лазарев, приурочил к 100-летию использования эфира для наркоза, то есть к 1946 году. Примерно тогда же, но после доклада Лазарева, в научной печати появилось сообщение группы американских исследователей о наркотическом действии ксенона на мышей, подтверждавшие данные Лазарева.
В 1951 году в США успешно провели первую операцию с ксеноном в качестве анестетика, однако дальше дело не пошло — главным образом, в связи с высокой стоимостью получения газа. Основной его источник — земная атмосфера, где он находится в очень малой концентрации: около 1 литра на 15 млн литров воздуха.
Ксенон вместо парниковых газов
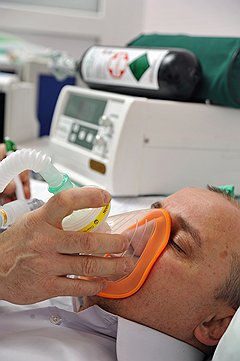
Ксеноновый наркоз дорог. Аппараты для ксеноновой анестезии оснащают специальными модулями, позволяющими оптимизировать поток газа
Фото: Григорий Собченко, Коммерсантъ
В 1980-1990-х годах к ксеноновой анестезии возник интерес. Сжижение воздуха в промышленных масштабах позволило снизить стоимость ксенона; к тому же, производство наиболее широко используемых сейчас галогенсодержащих анестетиков должно быть полностью прекращено к 2030 году — так записано в Киотском протоколе. Да и закись азота, негалогенсодержащий анестетик — тоже один из парниковых газов, поэтому будет ограничено и его производство. По этим причинам ксеноновая анестезия вызывает все больший интерес, и с конца XX века вопросы, связанные с ее применением, регулярно обсуждаются на всемирных и европейских анестезиологических конгрессах.
Главный вопрос для развития ксеноновой анестезии — производство газа. Сейчас ксенон в основном получают на металлургических производствах, для которых требуется большое количество жидкого кислорода. При первичном разделении воздуха на азот и кислород последний содержит незначительную примесь смеси криптона и ксенона, из которой ксенон затем выделяют путем многоступенчатого процесса. Из-за низкой концентрации в исходной смеси ксенон получается дорогим. При анестезии значительная часть газа еще и безвозвратно теряется, уходя в атмосферу с дыханием пациента, что увеличивает расход и без того дорогого газа.
Приоритетное развитие тяжелой — в частности, металлургической — промышленности в СССР в числе прочего привело к тому, что Россия и Украина сейчас обеспечивают каждая по 20% мирового производства ксенона.
Снижение стоимости ксенона создало ситуацию, когда основным тормозом в его медицинском применении становится отсутствие соответствующей правовой базы. В 1990-х годах в России впервые в мировой практике был проведен весь спектр доклинических и клинических испытаний в соответствии с регламентом Государственного фармакологического комитета, и с 1999 года ксенон приказом министра здравоохранения России разрешен к применению в качестве средства наркоза.
Ксенон — Мегаэнциклопедия Кирилла и Мефодия — статья
Ксено́н (лат. Xenon, от греческого xenos — чужой), Хе (читается «ксенон»), химический элемент с атомным номером 54, атомная масса 131, 29. Инертный, или благородный, газ. Расположен в группе VIIIA в 5 периоде периодической системы.
Природный атмосферный ксенон состоит из девяти изотопов: 124 Хе (0, 096%), 126 Хе (0, 090%), 128 Хе (1, 92%), 129 Хе (26, 44%), 130 Хе (4, 08), 131 Хе (21, 18%), 132 Хе (26, 89%), 134 Хе (10, 44%) и 136 Хе (8, 87%).
Радиус атома 0, 218 нм. Электронная конфигурация внешнего слоя 5s2p6 .Энергии последовательной ионизации — 12, 130, 21, 25, 32, 1 эВ. Электроотрицательность по Полингу 2, 6.Открыт английскими учеными У. Рамзаем и М. Траверсом в 1898 методом спектрального анализа как примесь к криптону. В 1962 в Канаде Н. Бартлетт получил первое устойчивое при комнатной температуре химическое соединение ксенона XePtF 6.Ксенон — редчайший газ земной атмосферы, содержание в воздухе 8, 6·10-5% по объему. Общие запасы ксенона в атмосфере 1, 6·1011м3.
Ксенон выделяют как побочный продукт при переработке воздуха на азот и кислород.
Ксенон — одноатомный газ без цвета и запаха. Температура кипения –108, 12 °C, плавления –11, 85 °C. Критическая температура 16, 52 °C, критическое давление 5, 84 МПа. Плотность 5, 85 кг/м3.
В 100 мл воды при 20 °C растворяется 9, 7 мл Xe.
Ксенон образует клатраты с водой и многими органическими веществами: Хе·5, 75Н2О, 4Хе·3С6Н5ОН и другие. В клатратах атомы-гости Xe занимают полости в кристаллических решетках веществ-хозяев.Непосредственно Xe взаимодействует только со фтором, образуя XeF2, XeF4 и XeF6. Дифторид ксенона XeF2 имеет тетрагональную решетку, температуру плавления 129 °C, плотность 4, 32 г/см3. Решетка тетрафторида XeF4 моноклинная, температура плавления 117, 1 °C, плотность 4, 0 г/см3. Решетка гексафторида XeF6 моноклинная, температура плавления 49, 5 °C, плотность 3, 41 г/см3.
Гидролизом XeF4 и XeF6 получают неустойчивые оксифториды XeОF4, XeО2F2, XeОF2, XeО3F2 и XeО2F4 и оксиды ХеО3 и ХеО4, которые при комнатной температуре они разлагаются на простые вещества.
Фториды ксенона взаимодействуют с водными растворами щелочей, образуя ксенаты МНХеО4 (М = Na, K, Rb, Cs), устойчивые до 180 °C. При гидролизе растворов XeF6, диспропорционировании XeО3 в щелочных растворах и при озонировании водных растворов XeО3 получены перксенаты Na4XeO6 и (NH4)4XeO6.
Ксенон используют для наполнения ламп накаливания, мощных газоразрядных и импульсных источников света.
Радиоактивные изотопы применяют в качестве источников излучения в радиографии и для диагностики в медицине, для обнаружения течи в вакуумных установках. Фториды ксенона используют для пассивации металлов.
Газ ксенон безвреден. Фториды ксенона ядовиты, ПДК в воздухе 0, 05 мг/м3.
- С. С. Бердоносов. Инертные газы вчера и сегодня. М., 1966.
- Фастовский В. Г., Ровинский А. Е., Петровский Ю. В. Инертные газы. М., 1972.
Ксенон № 54 химический элемент
КсенонИнертные газы обнаружены в атмосфере в 1894 г. После того как были открыты гелий, неон, аргон и криптон, завершающие четыре первых периода таблицы Менделеева, уже не вызывало сомнений, что пятый и шестой периоды тоже должны оканчиваться инертным газом. Но найти их удалось не сразу. Это и не удивительно: в 1 м3 воздуха 9,3 л аргона и всего лишь 0,08 мл ксенона.
Но к тому времени стараниями ученых, прежде всего англичанина Траверса, появилась возможность получать значительные количества жидкого воздуха. Стал доступен даже жидкий водород. Благодаря этому Рамзай совместно с Траверсом смог заняться исследованием наиболее трудно-летучей фракции воздуха, получающейся после отгонки гелия, водорода, неона, кислорода, азота и аргона. Остаток содержал Сырой (то есть неочищенный) криптон. Однако после откачки его в сосуде неизменно оставался пузырек газа. Этот газ голубовато светился в электрическом разряде и давал своеобразный спектр с линиями в областях от оранжевой до фиолетовой.
Характерные спектральные линии — визитная карточка элемента. У Рамзая и Траверса были все основания считать, что открыт новый инертный газ. Его назвали ксеноном, что в переводе с греческого значит «чужой»: в криптоновой фракции воздуха он действительно выглядел чужаком.
В поисках нового элемента и для изучения его свойств Рамзай и Траверс переработали около 100 т жидкого воздуха; индивидуальность ксенона как нового химического элемента они установили, оперируя всего 0,2 см3 этого газа. Необычайная для того времени тонкость эксперимента!
Хотя содержание ксенона в атмосфере крайне мало, именно воздух — практически единственный и неисчерпаемый источник ксенона. Неисчерпаемый — потому, что почти весь ксенон возвращается в атмосферу.
Процесс выделения благородных газов из воздуха описан многократно. Воздух, очищенный предварительно от углекислоты и влаги, сжижают, а затем начинают испарять. Сначала «летят» более легкие газы. После испарения основной массы воздуха рассортировывают оставшиеся тяжелые инертные газы.
Любопытно, что с точки зрения химика ксенон на самом деле оказался «чужим» среди инертных газов. Он первым вступил в химическую реакцию, первым образовал устойчивое соединение. И потому сделал неуместным сам термин «инертные газы».
Ксенон вступает в реакции
Когда-то сочетание слов «химия ксенона» казалось абсурдным. И все же дерзкая мысль о том, что ксенон может образовывать устойчивые соединения с галогенами, приходила в голову многим ученым. Так, еще в 1924 г. высказывалась идея, что некоторые соединения тяжелых инертных газов (в частности, фториды и хлориды ксенона) термодинамически вполне стабильны и могут существовать при обычных условиях. Через девять лет эту идею поддержали и развили известные теоретики — Полипг и Оддо.
Изучение электронной структуры оболочек криптона и ксенона с позиций квантовой механики привело к заключению, что эти газы в состоянии образовывать устойчивые соединения с фтором. Нашлись и экспериментаторы, решившие проверить гипотезу, но шло время, ставились опыты, а фторид ксенона не получался. В результате почти все работы в этой области были прекращены, и мнение об абсолютной инертности благородных газов утвердилось окончательно.
Однако в 1961 г. Бартлетт, сотрудник одного из университетов Канады, изучая свойства гексафторида платины — соединения более активного, чем сам фтор, установил, что потенциал ионизации у ксенона ниже, чем у кислорода (12,13 и 12,20 эв соответственно). Между тем кислород образовывал с гексафторидом платины соединение состава O2PtF6… Бартлетт ставит опыт и при комнатной температуре из газообразного гексафторида платины и газообразного ксенона получает твердое оранжево-желтое вещество — гексафторплатинат ксенона XePtF6, поведение которого ничем не отличается от поведения обычных химических соединений. При нагревании в вакууме XePtF6 возгоняется без разложения, в воде гидролизуется, выделяя ксенон:
2XePtFe + 6Н2O → 2Хе + O2 + 2PtO2 + 12HF.
Последующие работы Бартлетта позволили установить, что ксенон в зависимости от условий реакции образует два соединения с гексафторидом платины: XePtF6 и Xe(PtF6)2;. при гидролизе их получаются одни и те же конечные продукты.
Убедившись, что он действительно вступил в реакцию с гексафторидом платины, Бартлетт выступил с докладом и в 1962 г. опубликовал в журнале «Proceedings of the Chemical Society» статью, посвященную сделанному им открытию. Статья вызвала огромный интерес, хотя многие химики отнеслись к ней с нескрываемым недоверием. Но уже через три недели эксперимент Бартлетта повторила группа американских исследователей во главе с Черником в Аргоннской национальной лаборатории. Кроме того, они впервые синтезировали аналогичные соединения ксенона с гексафторидами рутения, родия и плутония. Так были открыты первые пять соединений ксенона: XePtF6, Xe(PtFe)2, XeRuFe, XeRhF6, XePuFe — миф об абсолютной инертности благородных газов развеян и заложено начало химии Xe.
Фториды ксенона
Настало время проверить правильность гипотезы о возможности прямого взаимодействия ксенона с фтором.
Смесь газов (1 часть ксенона и 5 частей фтора) поместили в никелевый (поскольку никель наиболее устойчив к действию фтора) сосуд и нагрели под сравнительно небольшим давлением. Через час сосуд быстро охладили, а оставшийся в нем газ откачали и проанализировали. Это был фтор. Весь газ прореагировал! Вскрыли сосуд и обнаружили в нем бесцветные кристаллы XeF,.
Тетрафторид Xe оказался вполне устойчивым соединением, молекула его имеет форму квадрата с ионами фтора по углам и ксеноном в центре. Тетрафторид Xe фторирует ртуть:
XeF4 + 2Hg → Хе + 2HgF2.
Платина тоже фторируется этим веществом, но только растворенным во фтористом водороде.
Интересно в химии ксенона то, что, меняя условия реакции, можно получить не только XeF4, но и другие фториды — XeF2, XeF6.
Советские химики В. М. Хуторецкий и В. А. Шпанский показали, что для синтеза дпфторида ксенона совсем не обязательны жесткие условия. По предложенному ими способу смесь ксенона и фтора (в молекулярном отношении 1:1) подается в сосуд из никеля или нержавеющей стали, и при повышении давления до 35 атм начинается самопроизвольная реакция.
Дифторпд ксенона XeF2 можно получить, не пользуясь элементарным фтором. Он образуется при действии электрического разряда на смесь ксенона и четырехфтористого углерода. Возможен, конечно, и прямой синтез. Очень чистый XeF2 получается, если смесь ксенона и фтора облучить ультрафиолетом. Растворимость дифторида в воде невелика, однако раствор его — сильнейший окислитель. Постепенно он саморазлагается на ксенон, кислород и фтористый водород; особенно быстро разложение идет в щелочной среде. Дифторид имеет резкий специфический запах.
Большой теоретический интерес представляет метод синтеза дифторида ксенона, основанный на воздействии на смесь газов ультрафиолетового излучения (длина волн порядка 2500—3500 А). Излучение вызывает расщепление, молекул фтора F2 на свободные атомы. В этом и заключается причина образования дифторида: атомарный фтор необычайно активен.
Для получения XeFe требуются более жесткие условия: 700° С и 200 атм. В таких условиях в смеси Xe и фтора (отношение от 1:4 до 1 : 20) практически весь ксенон превращается в XeF6.
Гексафторид ксенона черезвычайно активен и разлагается со взрывом. Он легко реагирует с фторидами щелочных металлов (кроме LiF): XeF6 + RbF = RbXeF7, но при 50° С эта соль разлагается: 2RbXeF7 = XeF6 + Rb2XeF8.
Сообщения о синтезе высшего фторида XeFs, устойчивого лишь при температуре ниже 77° К, не подтвердились.
Синтез первых соединений Xe поставил перед химиками вопрос о месте инертных газов в периодической системе элементов. Прежде благородные газы были выделены в отдельную нулевую группу, что вполне отвечало представлению об их валентности. Но, когда ксенон вступил в химическую реакцию, когда стали известны его высший оксид ХеO4 и оксифториды, в которых валентность ксенона равна 8 (а это вполне согласуется со строением его электронной оболочки), инертные газы решили перенести в VIII группу. Нулевая группа перестала существовать.
Заставить ксенон вступить в реакцию без участия фтора (или некоторых его соединений) пока не удалось. Все известные ныне соединения ксенона получены из его фторидов. Эти вещества обладают повышенной реакционной способностью. Лучше всего изучено взаимодействие фторидов ксенона с водой.
Гидролиз XeF4 в кислой среде ведет к образованию окиси ксенона ХеO3— бесцветных, расплывающихся на воздухе кристаллов. Молекула ХеO3 имеет структуру приплюснутой треугольной пирамиды с атомом ксенона в вершине. Это соединение крайне неустойчиво; при его разложении мощность взрыва приближается к мощности взрыва тротила. Достаточно нескольких сотен миллиграммов ХеO3, чтобы эксикатор разнесло в куски. Не исключено, что со временем трехокись ксенона будут использовать как взрывчатое вещество дробящего действия. Такая взрывчатка была бы очень удобна, потому что все продукты взрывной реакции — газы.
Пока же использовать для этой цели трехокись ксенона слишком дорого — ведь ксенона в атмосфере меньше, чем золота в морской воде, и процесс его выделения слишком трудоемок. Напомним, что для получения 1 м3 ксенона нужно переработать 11 млн. м3 воздуха.
Соответствующая трехокиси неустойчивая кислота шестивалентного ксенона Н2ХеO4 образуется в результате гидролиза XeF6 при 0°С:
XeF6 + 4Н20 → 6HF + Н2ХеO4.
Если к продуктам этой реакции быстро добавить Ва(ОН)2, выпадает белый аморфный осадок ВаХеO4. При 125° С он разлагается на окись бария, ксенон и кислород. Получены аналогичные соли — ксенонаты аммония, натрия, лития, кальция и калия.
При действии озона на раствор ХеO3 в одномолярном едком натре образуется натриевая соль высшей кислоты ксенона Na4XeO6. Перксенонат натрия может быть выделен в виде бесцветного кристаллогидрата Na4XeO6 • 6Н2O. К образованию перксенонатов приводит и гидролиз XeF6 в гидроокисях натрия и калия. Если твердую соль Na4XeO6 об-работать раствором нитрата свинца, серебра или уранила UO22+ получаются соответствующие перксенопаты. Перксенонат серебра — черного цвета, свинца и уранила — желтого. Перксенонатанион — самый сильный из ионов окислителей. Чрезвычайно мощный окислитель и перхлорат ксенона Хе(СlO4)г, в котором ксенон играет роль катиона. Из всех окислителей-перхлоратов он самый сильный.
Окисел, соответствующий высшей кислоте ксенона, получают при взаимодействии Na4XeO6 с охлажденной безводной серной кислотой. Получается уже упоминавшаяся четырехокись ксенона ХеO4. Ее молекула построена в виде тетраэдра с атомом ксенона в центре. Вещество это нестойко. При температуре выше 0°С оно разлагается на кислород и ксенон. Иногда разложение четырехокиси ксенона (трехокиси — тоже) носит характер взрыва.
И все-таки большинство известных ныне соединений ксенона (а всего их получено примерно полторы сотни) — бескислородные. Преимущественно это двойные соли — продукты взаимодействия фторидов ксенона с фторидами сурьмы, мышьяка, бора, тантала, ниобия, хрома, платиновых металлов.
Сильные окислительные свойства соединений ксенона химики уже используют в своих целях. Так, водные растворы дифторида ксенона позволили впервые в мировой практике получить перброматы — соединения семивалентного брома, состав которых МВгO4, где М — одновалентный металл.
