Удельная теплота парообразования и конденсации — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 19 декабря 2018; проверки требуют 6 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 19 декабря 2018; проверки требуют 6 правок.Уде́льная теплота́ парообразова́ния и конденса́ции — физическая величина, показывающая, какое количество теплоты необходимо, чтобы обратить количество жидкости с единичной массой в пар , при данной температуре жидкости и без её изменения (температуры) в процессе испарения. Равна удельной теплоте конденсации единичной массы пара в жидкость.
Удельная теплота парообразования и конденсации обозначается буквой L{\displaystyle L}. Рассчитывается по формуле:
- L=Qm,{\displaystyle L={\,Q \over m},}
где Q — теплота, истраченная на превращение жидкости в пар или пара в жидкость,
Наименьшее значение удельной теплоты парообразования будет при температуре кипения жидкости.
Размерность удельной теплоты парообразования в СИ — Дж/кг. Устаревшие, но иногда применяемые единицы для теплоты парообразования — ккал/кг и кал/кг.
В химии теплота парообразования обычно приводится к молю вещества. Эта величина называется молярной теплотой испарения (конденсации); единица её измерения — Дж/моль. Также используются устаревшие единицы: ккал/моль, кал/моль.
Удельная теплота парообразования некоторых веществ при нормальном атмосферном давлении (760 мм. рт. ст. = 101,325 кПа) и температуре, равной температуре кипения вещества[1]:
| ЗАДАЧНИК ОНЛ@ЙН БИБЛИОТЕКА 1 БИБЛИОТЕКА 2 | Удельная теплота плавления. Удельная теплота парообразования (испарения). Критические параметры некоторых веществ. Удельная теплота сгорания.Удельная теплота плавления металлов
Удельная теплота плавления некоторых веществ (при нормальном атмосферном давлении)
Изменение объемов веществ при их плавленииВ таблице укзан объем жидкости Vж, образующийся при плавлении твердых тел из различных веществ объемом 1000 см3
Большинство веществ при переходе из твердого состояния в жидкое увеличивает свой объем. Исключение составляют лед, висмут и некоторые другие вещества. Удельная теплота испарения (парообразования) воды при различной температуре | ||||
t, oC | Удельная теплота испарения | t, oC | Удельная теплота испарения | ||
кДж/кг | калл/кг | кДж/кг | калл/кг | ||
| 0 | 2501 | 597 | 80 | 2308 | 551 |
| 5 | 2489 | 594 | 100 | 2256 | 539 |
| 10 | 2477 | 592 | 160 | 2083 | 497 |
| 15 | 2466 | 589 | 200 | 1941 | 464 |
| 18 | 2458 | 587 | 300 | 1404 | 335 |
| 20 | 2453 | 586 | 370 | 438 | 105 |
| 30 | 2430 | 580 | 374 | 115 | 27 |
| 50 | 2382 | 569 | 374,15* | 0 | 0 |
* При температуре 374,15 oC и давлении 22,13 Па (225,64 ат) вода находится в критическом состоянии. В этом состоянии жидкость и ее насыщенный пар обладают одиноковыми свойствами — разница между водой и ее насыщенным паром исчезает.
Изменение объемов жидкостей при испарении и газов (паров) при конденсации
Испаряющаяся жидкость | Vг, л | Конденсирующийся газ (пар) | Vж, л |
| Азот | 716 | Азот | 1,42 |
| Вода (при ) | 1780 | Водяной пар | 0,737 |
| Воздух | 749 | Воздух | 1,38 |
| Гелий | 774 | Гелий | 1,31 |
| Кислород | 886 | Кислород | 1,15 |
| Метан | 656 | Метан | 1,55 |
В таблице указан объем газа (пара), образующегося при испарении 1л жидкости, взятой при температу ре 20 oС и нормальном атмосферном давлении, а также объем жидкости образующейся при конденсации 1 м3 газа (пара).
Удельная теплота парообразования жидкостей и расплавленных металлов
(при температуре кипения и нормальном атмосферном давлении)Жидкость | Удельная теплота испарения | Жидкость | Удельная теплота испарения | ||
кДж/кг | кал/кг | кДж/кг | кал/кг | ||
| Азот жидкий | 201 | 48 | Водород жидкий | 450 | 108 |
| Алюминий | 9200 | 2200 | Воздух | 197 | 47 |
| Бензин | 230-310 | 55-75 | Гелий жидкий | 23 | 5,5 |
| Висмут | 840 | 200 | Железо | 6300 | 1500 |
| Вода (при t=0 oC) | 2500 | 597 | Керосин | 209-230 | 50-55 |
| Вода (при t=20 oC) | 2450 | 586 | Кислород жидкий | 214 | 51 |
| Вода (при t=100 oC) | 2260 | 539 | Магний | 5440 | 1300 |
| Вода (при t=370 oC) | 440 | 105 | Медь | 4800 | 1290 |
| Вода (при t=374,15 oC) | 0 | 0 | Олово | 3010 | 720 |
| Ртуть | 293 | 70 | |||
| Свинец | 860 | 210 | |||
| Спирт этиловый | 906 | 216 | |||
| Эфир этиловый | 356 | 85 | |||
Удельная теплота испарения (парообразования) некоторых твердых веществ
Вещество | Удельная теплота испарения | Вещество | Удельная теплота испарения | ||
кДж/кг | калл/кг | кДж/кг | калл/кг | ||
| Йод | 226 | 54 | Мышяк | 427 | 102 |
| Камфара | 387,2 | 92,5 | Сухой лед | 586 | 140 |
| Лед | 2834 | 677 | |||
Примечание. Непосредственный переход вещества из твердого состояния в газообразное, минуя превращение в жидкое состояние, называется сублимацией.
Критические параметры некоторых веществ
Вещество | Критическая температура, oC | Критическая плотность, кг/м3 | Критическое давление | |
МПа | ат | |||
| Азот | -147.1 | 311 | 3.39 | 34.6 |
| Аммиак | 132.4 | 235 | 11.5 | 117 |
| Ацетилен | 35.7 | 231 | 6.24 | 63.7 |
| Вода | 374.2 | 307 | 22.13 | 225.65 |
| Водород | -239.9 | 31.0 | 1.30 | 13.5 |
| Воздух | -140.7 | 350 | 3.77 | 38.5 |
| Гелий | -267.9 | 69.3 | 0.23 | 2.3 |
| Кислород | -118.8 | 430 | 5.04 | 51.4 |
| Нафталин | 469 | 314 | 3.98 | 40.6 |
| Оксид углерода (II) | -139 | 301 | 3.5 | 36 |
| Оксид углерода (IV) | 31.0 | 460 | 7.35 | 75.0 |
| Спирт | 243.5 | 276 | 6.38 | 65.2 |
| Хлор | 144.0 | 573 | 7.70 | 78.5 |
| Эфир | 193.8 | 260 | 3.60 | 37.0 |
Удельная теплота сгорания некоторых пищевых продуктов
Продукт | Удельная теплота сгорания | Продукт | Удельная теплота сгорания | ||
кДж/кг | калл/кг | кДж/кг | калл/кг | ||
| Батоны простые | 10470 | 2500 | Мясо куриное | 5380 | 1280 |
| Виноград | 2400 | 700 | Огурцы свежие | 570 | 140 |
| Говядина | 7520 | 1800 | Окунь, щука | 3520 | 840 |
| Земляника садовая | 1730 | 443 | Сахар | 17150 | 4100 |
| Картофель | 3770 | 900 | Сметана | 14800 | 3530 |
| Кефир | 2700 | 640 | Смородина черная | 2470 | 590 |
| Малина | 1920 | 460 | Хлеб пшеничный | 8930 | 2130 |
| Масло сливочное | 32700 | 7800 | Хлеб ржаной | 8620 | 2060 |
| Молоко | 2800 | 670 | Яблоки | 2010 | 480 |
| Морковь | 1720 | 400 | Яйца | 6900 | 1650 |
| Мороженое сливочное | 7500 | 1790 | |||
Удельная теплота сгорания различных видов топлива и некоторых веществ
Топливо, вещество | Удельная теплота сгорания | |
МДж/кг | калл/кг | |
| Условное топливо | 29,3 | 7000 |
Твердое | ||
| Антрацит | 26,8-31,4 | 6400-7500 |
| Древесный уголь | 31,5-34,4 | 7500-8200 |
| Дрова (воздушно-сухие) | 8,4-11 | 2000-2500 |
| Каменный уголь | ≈ 27 | ≈ 6500 |
| Порох | 3,8 | 900 |
| Сланцы горючие | 7,5-15,0 | 1800-3600 |
| Твердые ракетные топлива | 4,2-10,5 | 100-2500 |
| Торф | 10,5-14,5 | 2500-3500 |
| Тротил (взрывчатое вещество) | 15 | 3600 |
| Уголь: | ||
| канско-акчинский | 15,5 | 3700 |
| подмосковный | 10,5 | 2500 |
| челябинский | 14,6 | 3500 |
| экибастузский | 16,1 | 3840 |
Жидкое | ||
| Бензин | 44-47 | 10500-11200 |
| Дизельное автотракторное | 42,7 | 10200 |
| Керосин | 44-46 | 10500-11000 |
| Нефть | 43,5-46 | 10400-11000 |
| Спирт | 27,0 | 6450 |
| Топливо для ЖРД (керосин + жидкий кислород) | 9,2 | 2200 |
| Топливо для реактивных двигателей самолетов (ТС-1) | 42,9 | 10250 |
Газообразное | ||
| Ацетилен | 48,1 | 11500 |
| Водород | 120 | 28600 |
| Газ природный | 41-49 | 9800-11700 |
| Метан | 50,0 | 11950 |
| Оксид углерода (II) | 10,1 | 2420 |
…
Удельная теплота плавления — СПИШИ У АНТОШКИ
Для того, чтобы расплавить какое-либо вещество в твердом состоянии, необходимо его нагреть.Опыты показывают, что для разных веществ одной массы требуется разное количество теплоты для полного его расплавления.
То есть существует определенная величина, от которой зависит, сколько тепла необходимо поглотить веществу для расплавления. И величина эта различна для разных веществ. Эта величина в физике называется удельная теплота плавления вещества. Удельная теплота плавления показывает, какое кол теплоты необходимо для полного превращения 1 кг вещества из твердого состояния в жидкое, взятого при температуре плавления.Обозначают удельную теплоту плавления греческой буквой λ (лямбда), а единицей измерения является 1 Дж/кг.
Формула удельной теплоты плавления
Удельная теплота плавления находится по формуле:
λ = Q/m,
где Q – это количество теплоты, необходимое для того, чтобы расплавить тело массой m.
Удельная теплота плавления некоторых веществ представлена в таблицеКоличество теплоты, необходимой для плавления вещества, равно произведению удельной теплоты плавления на массу данного вещества.
Q = λ*m,
Опять-таки из опытов известно, что при отвердевании вещества выделяют такое же количество тепла, которое требовалось затратить на их расплавление. Молекулы, теряя энергию, образуют кристаллы, будучи не в силах сопротивляться притяжению других молекул. И опять-таки, температура тела не будет понижаться вплоть до того момента, пока не отвердеет все тело, и пока не выделится вся энергия, которая была затрачена на его плавление. То есть удельная теплота плавления показывает, как сколько надо затратить энергии, чтобы расплавить тело массой m, так и сколько энергии выделится при отвердевании данного тела.
Q = λ*m
Когда тело кристаллизуется, Q пишется со знаком «-», так как тепло выделяется.
Содержание статьи: Удельная теплота плавления. Удельная теплота парообразования (испарения). Критические параметры некоторых веществ. Удельная теплота сгорания.
| |||||
Металл | Удельная теплота плавления | Металл | Удельная теплота плавления | ||
кДж/кг | кал/г | кДж/кг | кал/г | ||
| Алюминий | 393 | 94 | Платина | 113 | 27 |
| Вольфрам | 184 | 44 | Ртуть | 12 | 2,8 |
| Железо | 270 | 64,5 | Свинец | 24,3 | 5,8 |
| Золото | 67 | 16 | Серебро | 87 | 21 |
| Магний | 370 | 89 | Сталь | 84 | 20 |
| Медь | 213 | 51 | Тантал | 174 | 41 |
| Натрий | 113 | 27 | Цинк | 112,2 | 26,8 |
| Олово | 59 | 14 | Чугун | 96-140 | 23-33 |
Удельная теплота плавления некоторых веществ (при нормальном атмосферном давлении)
Вещество | Удельная теплота плавления | Вещество | Удельная теплота плавления | ||
кДж/кг | кал/г | кДж/кг | кал/г | ||
| Азот | 25,7 | 6,2 | Нафталин | 151 | 36 |
| Водород | 59 | 14 | Парафин | 150 | 35 |
| Воск | 176 | 42 | Спирт | 105 | 25 |
| Глицерин | 199 | 47,5 | Стеарин | 201 | 48 |
| Кислород | 13,8 | 3,3 | Хлор | 188 | 45 |
| Лед | 330 | 80 | Эфир | 113 | 27 |
Изменение объемов веществ при их плавлении
В таблице укзан объем жидкости Vж, образующийся при плавлении твердых тел из различных веществ объемом 1000 см3
Вещество | Vж, см3 | Вещество | Vж, см3 |
| Алюминий | 1066 | Ртуть | 1036 |
| Висмут | 967 | Свинец | 1036 |
| Золото | 1052 | Серебро | 1050 |
| Кремний | 900 | Сурьма | 991 |
| Лед | 917 | Цинк | 1069 |
| Олово | 1026 | Чугун серый | 988-994 |
Большинство веществ при переходе из твердого состояния в жидкое увеличивает свой объем. Исключение составляют лед, висмут и некоторые другие вещества.
Удельная теплота испарения (парообразования) воды при различной температуре
и нормальном атмосферном давлении
t, oC | Удельная теплота испарения | t, oC | Удельная теплота испарения | ||
кДж/кг | калл/кг | кДж/кг | калл/кг | ||
| 0 | 2501 | 597 | 80 | 2308 | 551 |
| 5 | 2489 | 594 | 100 | 2256 | 539 |
| 10 | 2477 | 592 | 160 | 2083 | 497 |
| 15 | 2466 | 589 | 200 | 1941 | 464 |
| 18 | 2458 | 587 | 300 | 1404 | 335 |
| 20 | 2453 | 586 | 370 | 438 | 105 |
| 30 | 2430 | 580 | 374 | 115 | 27 |
| 50 | 2382 | 569 | 374,15* | 0 | 0 |
* При температуре 374,15 oC и давлении 22,13 Па (225,64 ат) вода находится в критическом состоянии. В этом состоянии жидкость и ее насыщенный пар обладают одиноковыми свойствами — разница между водой и ее насыщенным паром исчезает.

Изменение объемов жидкостей при испарении и газов (паров) при конденсации
Испаряющаяся жидкость | Vг, л | Конденсирующийся газ (пар) | Vж, л |
| Азот | 716 | Азот | 1,42 |
| Вода (при ) | 1780 | Водяной пар | 0,737 |
| Воздух | 749 | Воздух | 1,38 |
| Гелий | 774 | Гелий | 1,31 |
| Кислород | 886 | Кислород | 1,15 |
| Метан | 656 | Метан | 1,55 |
В таблице указан объем газа (пара), образующегося при испарении 1л жидкости, взятой при температу ре 20 oС и нормальном атмосферном давлении, а также объем жидкости образующейся при конденсации 1 м3 газа (пара).
Удельная теплота парообразования жидкостей и расплавленных металлов
(при температуре кипения и нормальном атмосферном давлении)
Жидкость | Удельная теплота испарения | Жидкость | Удельная теплота испарения | ||
кДж/кг | кал/кг | кДж/кг | кал/кг | ||
| Азот жидкий | 201 | 48 | Водород жидкий | 450 | 108 |
| Алюминий | 9200 | 2200 | Воздух | 197 | 47 |
| Бензин | 230-310 | 55-75 | Гелий жидкий | 23 | 5,5 |
| Висмут | 840 | 200 | Железо | 6300 | 1500 |
| Вода (при t=0 oC) | 2500 | 597 | Керосин | 209-230 | 50-55 |
| Вода (при t=20 oC) | 2450 | 586 | Кислород жидкий | 214 | 51 |
| Вода (при t=100 oC) | 2260 | 539 | Магний | 5440 | 1300 |
| Вода (при t=370 oC) | 440 | 105 | Медь | 4800 | 1290 |
| Вода (при t=374,15 oC) | 0 | 0 | Олово | 3010 | 720 |
| Ртуть | 293 | 70 | |||
| Свинец | 860 | 210 | |||
| Спирт этиловый | 906 | 216 | |||
| Эфир этиловый | 356 | 85 | |||
Удельная теплота испарения (парообразования) некоторых твердых веществ
Вещество | Удельная теплота испарения | Вещество | Удельная теплота испарения | ||
кДж/кг | калл/кг | кДж/кг | калл/кг | ||
| Йод | 226 | 54 | Мышяк | 427 | 102 |
| Камфара | 387,2 | 92,5 | Сухой лед | 586 | 140 |
| Лед | 2834 | 677 | |||
Примечание. Непосредственный переход вещества из твердого состояния в газообразное, минуя превращение в жидкое состояние, называется сублимацией.
Критические параметры некоторых веществ
Вещество | Критическая температура, oC | Критическая плотность, кг/м3 | Критическое давление | |
МПа | ат | |||
| Азот | -147.1 | 311 | 3.39 | 34.6 |
| Аммиак | 132.4 | 235 | 11.5 | 117 |
| Ацетилен | 35.7 | 231 | 6.24 | 63.7 |
| Вода | 374.2 | 307 | 22.13 | 225.65 |
| Водород | -239.9 | 31.0 | 1.30 | 13.5 |
| Воздух | -140.7 | 350 | 3.77 | 38.5 |
| Гелий | -267.9 | 69.3 | 0.23 | 2.3 |
| Кислород | -118.8 | 430 | 5.04 | 51.4 |
| Нафталин | 469 | 314 | 3.98 | 40.6 |
| Оксид углерода (II) | -139 | 301 | 3.5 | 36 |
| Оксид углерода (IV) | 31.0 | 460 | 7.35 | 75.0 |
| Спирт | 243.5 | 276 | 6.38 | 65.2 |
| Хлор | 144.0 | 573 | 7.70 | 78.5 |
| Эфир | 193.8 | 260 | 3.60 | 37.0 |
Удельная теплота сгорания некоторых пищевых продуктов
Продукт | Удельная теплота сгорания | Продукт | Удельная теплота сгорания | ||
кДж/кг | калл/кг | кДж/кг | калл/кг | ||
| Батоны простые | 10470 | 2500 | Мясо куриное | 5380 | 1280 |
| Виноград | 2400 | 700 | Огурцы свежие | 570 | 140 |
| Говядина | 7520 | 1800 | Окунь, щука | 3520 | 840 |
| Земляника садовая | 1730 | 443 | Сахар | 17150 | 4100 |
| Картофель | 3770 | 900 | Сметана | 14800 | 3530 |
| Кефир | 2700 | 640 | Смородина черная | 2470 | 590 |
| Малина | 1920 | 460 | Хлеб пшеничный | 8930 | 2130 |
| Масло сливочное | 32700 | 7800 | Хлеб ржаной | 8620 | 2060 |
| Молоко | 2800 | 670 | Яблоки | 2010 | 480 |
| Морковь | 1720 | 400 | Яйца | 6900 | 1650 |
| Мороженое сливочное | 7500 | 1790 | |||
Удельная теплота сгорания различных видов топлива и некоторых веществ
Топливо, вещество | Удельная теплота сгорания | |
МДж/кг | калл/кг | |
| Условное топливо | 29,3 | 7000 |
Твердое | ||
| Антрацит | 26,8-31,4 | 6400-7500 |
| Древесный уголь | 31,5-34,4 | 7500-8200 |
| Дрова (воздушно-сухие) | 8,4-11 | 2000-2500 |
| Каменный уголь | ≈ 27 | ≈ 6500 |
| Порох | 3,8 | 900 |
| Сланцы горючие | 7,5-15,0 | 1800-3600 |
| Твердые ракетные топлива | 4,2-10,5 | 100-2500 |
| Торф | 10,5-14,5 | 2500-3500 |
| Тротил (взрывчатое вещество) | 15 | 3600 |
| Уголь: | ||
| канско-акчинский | 15,5 | 3700 |
| подмосковный | 10,5 | 2500 |
| челябинский | 14,6 | 3500 |
| экибастузский | 16,1 | 3840 |
Жидкое | ||
| Бензин | 44-47 | 10500-11200 |
| Дизельное автотракторное | 42,7 | 10200 |
| Керосин | 44-46 | 10500-11000 |
| Нефть | 43,5-46 | 10400-11000 |
| Спирт | 27,0 | 6450 |
| Топливо для ЖРД (керосин + жидкий кислород) | 9,2 | 2200 |
| Топливо для реактивных двигателей самолетов (ТС-1) | 42,9 | 10250 |
Газообразное | ||
| Ацетилен | 48,1 | 11500 |
| Водород | 120 | 28600 |
| Газ природный | 41-49 | 9800-11700 |
| Метан | 50,0 | 11950 |
| Оксид углерода (II) | 10,1 | 2420 |
…
Source: www.kilomol.ru
Почитайте еще:
просто и доходчиво – формула, таблица
Почему твердое тело становится жидким?Под плавлением в физике подразумевают процесс превращения тела из твердого состояния в жидкое, под действием температуры. Классическим повсеместным примером плавления из жизни является таяние льдов, их превращение в воду, или превращение твердого куска олова в жидкий припой под действием паяльника. Передача тому или иному телу определенного количества тепла может изменить его агрегатное состояние, это удивительное свойство твердых тел превращаться в жидкие под действием температуры имеет большое значение для науки и техники. Ученым (а также техникам, инженерам) важно знать при каких температурах плавятся те или иные металлы (а порой и не только металлы), и для этого в физику вошло такое понятие как «удельная теплота плавления». О том, что означает удельная теплота плавления, какая ее формула расчета, читайте далее.
Почему твердое тело становится жидким?
Но давайте для начала разберем, как происходит сам процесс плавления на атомно-молекулярном уровне. Как мы знаем, в любом твердом теле все атомы и молекулы находятся четко и упорядочено в узлах кристаллической решетки, благодаря этому твердое тело и является твердым.
Но что происходит, если мы начинает это самое гипотетическое твердо тело сильно нагревать – под действием температуры атомы и молекулы резко увеличивают свою кинетическую энергию и по достижении определенных критических значений, они начинают покидать кристаллическую решетку, вырываться из нее. А само твердое тело начинает буквально распадаться, превращаясь в некое жидкое вещество – так происходит плавление.
При этом процесс плавления происходит не резким скачком, а постепенно. Также стоит заметить, что плавление относится к эндотермическим процессам, то есть процессам, при которых происходит поглощение теплоты.
Процесс обратный к плавлению называют кристаллизацией – это когда тело из жидкого состояния наоборот превращается в твердое. Если вы оставите воду в морозилке, она через какое-то время превратится в лед – это самый типичный пример кристаллизации из реальной жизни.
Определение удельной теплоты плавления
Удельной теплотой плавления называют физическую величину равную количеству тепла (в джоулях), которое необходимо передать твердому телу массой 1 кг, чтобы полностью перевести его в жидкое состояние. Удельную теплоту плавления обозначают греческой буквой «лямбда» – λ.
Формула удельной теплоты плавление выглядит так:
λ = Q/m
Где m – масса плавящегося вещества, а Q – количество тепла, переданное веществу при плавлении.
Зная значение удельной теплоты плавления, мы можем определить, какое количество тепла необходимо передать для тела с той или иной массой, для его полного расплавления:
Q = λ * m
Для разных веществ удельная теплота плавления была определена экспериментально.
Единица удельной теплоты плавления
Многих интересует вопрос, в каких единицах измеряется удельная теплота плавления. Так вот, удельная теплота плавления измеряется в Джоулях на килограмм – Дж/кг.
Таблица удельной теплоты плавления
Значение удельной теплоты для разных веществ: золота, серебра, цинка, олова и многих других металлов можно найти в специальных таблицах и справочниках. Обычно эти значения приводятся в виде таблицы.
Вашему вниманию таблица удельной теплоты плавления разных веществ
| Вещество | 105 * Дж/кг | ккал/кг | Вещество | 105 * Дж/кг | ккал/кг |
| Алюминий | 3,8 | 92 | Ртуть | 0,1 | 3,0 |
| Железо | 2,7 | 65 | Свинец | 0,3 | 6,0 |
| Лед | 3,3 | 80 | Серебро | 0,87 | 21 |
| Медь | 1,8 | 42 | Сталь | 0,8 | 20 |
| Нафталин | 1,5 | 36 | Цинк | 1,2 | 28 |
| Олово | 0,58 | 14 | Платина | 1,01 | 24,1 |
| Парафин | 1,5 | 35 | Золото | 0,66 | 15,8 |
Интересный факт: самым тугоплавким металлом на сегодняшний день является карбид тантала – ТаС. Для его плавления необходима температура 3990 С. Покрытия из ТаС применяют для защиты металлических форм, в которых отливают детали из алюминия
Рекомендованная литература и полезные ссылки
- Енохович А. С. Краткий справочник по физике. — М.: «Высшая школа», 1976. — С. 114. — 288 с.
- Atkins, Peter & Jones, Loretta (2008), Chemical Principles: The Quest for Insight (4th ed.), W. H. Freeman and Company, с. 236, ISBN 0-7167-7355-4
- Hoffer J. K., Gardner W. R., Waterfield C. G., Phillips N. E. Thermodynamic properties of 4He. II. The bcc phase and the P-T and VT phase diagrams below 2 K (англ.) // Journal of Low Temperature Physics (англ.)русск. : journal. — 1976. — April (vol. 23, no. 1). — P. 63—102. — DOI:10.1007/BF00117245. — Bibcode: 1976JLTP…23…63H.
Удельная теплота плавления, видео
Эта статья доступна на английском языке – Enthalpy of Fusion.
§ 8.8. Теплота плавления
При плавлении происходит разрушение пространственной решетки кристаллического тела. На этот процесс расходуется определенное количество энергии от какого-нибудь внешнего источника. В результате внутренняя энергия тела в процессе плавления увеличивается.
Количество теплоты, необходимое для перехода тела из твердого состояния в жидкое при температуре плавления, называется теплотой плавления.
В процессе отвердевания тела, наоборот, внутренняя энергия тела уменьшается. Тело отдает теплоту окружающим телам. Согласно закону сохранения энергии количество теплоты, поглощенное телом при плавлении (при температуре плавления), равно количеству теплоты, отданному этим телом при отвердевании (при температуре отвердевания).
Удельная теплота плавления
Теплота плавления зависит от массы плавящегося вещества и его свойств. Зависимость теплоты плавления от рода вещества характеризуют удельной теплотой плавления этого вещества.
Удельной теплотой плавления вещества называется отношение теплоты плавления тела из этого вещества к массе тела.
Обозначим теплоту плавления через Qпл, массу тела буквой т и удельную теплоту плавления буквой λ. Тогда
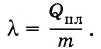 (8.8.1)
(8.8.1)
Таким образом, чтобы расплавить кристаллическое тело массой m, взятое при температуре плавления, необходимо количество теплоты, равное
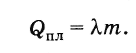 (8.8.2)
(8.8.2)
Теплота кристаллизации
Согласно закону сохранения энергии количество теплоты, выделяемое при кристаллизации тела (при температуре кристаллизации), равно
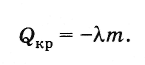 (8.8.3)
(8.8.3)
Из формулы (8.8.1) следует, что удельная теплота плавления в СИ выражается в джоулях на килограмм.
Довольно велика удельная теплота плавления льда 333,7 кДж/кг. Удельная теплота плавления свинца всего лишь 23 кДж/кг, а золота — 65,7 кДж/кг.
Формулы (8.8.2) и (8.8.3) используются при решении задач на составление уравнений теплового баланса в тех случаях, когда мы имеем дело с плавлением и отвердеванием кристаллических тел.
Роль теплоты плавления льда и кристаллизации воды в природе
Поглощение теплоты при таянии льда и выделение ее при замерзании воды оказывают значительное влияние на изменение температуры воздуха, особенно вблизи водоемов. Все вы, вероятно, замечали, что во время обильных снегопадов обычно наступает потепление.
Очень важно большое значение удельной теплоты плавления льда. Еще в конце XVIII в. шотландский ученый Д. Блэк (1728—1799), открывший существование теплоты плавления и кристаллизации, писал: «Если бы лед не обладал значительной теплотой плавления, то тогда весной вся масса льда должна была бы растаять в несколько минут или секунд, так как теплота из воздуха непрерывно передается льду. Но тогда последствия этого были бы ужасны: ведь и при существующем положении возникают большие наводнения и сильные потоки воды при таянии больших масс льда и снега».
Сопло космической ракеты
Приведем интересный технический пример практического использования теплоты плавления и парообразования. При изготовлении сопла для космической ракеты следует учитывать, что струя газов, выходящая из сопла ракеты, имеет температуру около 4000 °С. В природе практически отсутствуют материалы, которые в чистом виде могли бы выдержать такую температуру. Поэтому приходится прибегать ко всякого рода ухищрениям, чтобы охладить материал сопла во время горения топлива.
Сопло изготавливают методом порошковой металлургии. В полость формы закладывается порошок тугоплавкого металла (вольфрам). Затем его подвергают сдавливанию. Порошок спекается, получается пористая структура типа пемзы. Затем эта «пемза» пропитывается медью (ее температура плавления всего 1083 °С).
Полученный материал называется псевдосплавом. На рисунке 8.31 показана фотография микроструктуры псевдосплава. На белом фоне вольфрамового каркаса видны медные включения неправильной формы. Этот сплав может, как это ни невероятно, кратковременно работать даже при температуре газов, образующихся при сгорании топлива, т. е. выше 4000°С.


Рис. 8.31
Происходит это следующим образом. Вначале температура сплава растет, пока не достигнет температуры плавления меди t1 (рис. 8.32). После этого температура сопла не будет меняться, пока вся медь не расплавится (промежуток времени от τ1 до τ2). В дальнейшем температура опять возрастает до тех пор, пока медь не закипит. Это происходит при температуре t2 = 2595 °С, меньшей температуры плавления вольфрама (3380 °С). Пока вся медь не выкипит, температура сопла опять меняться не будет, так как испаряющаяся медь забирает теплоту от вольфрама (промежуток времени от τ3 до τ4). Конечно, сколько угодно долго сопло работать не будет. После испарения меди вольфрам опять начнет нагреваться. Однако двигатель ракеты работает всего лишь несколько минут, а за это время сопло не успеет перегреться и расплавиться.
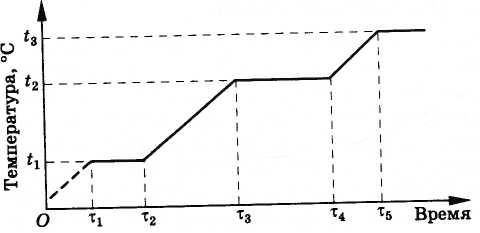
Рис. 8.32
Удельная теплота плавления
Для того, чтобы расплавить какое-либо вещество в твердом состоянии, необходимо его нагреть. И при нагревании любого тела отмечается одна любопытная особенность
Особенность такая: температура тела растет вплоть до температуры плавления, а потом останавливается до того момента, пока все тело целиком не перейдет в жидкое состояние. После расплавления температура вновь начинает расти, если, конечно, продолжать нагревание. То есть, существует промежуток времени, во время которого мы нагреваем тело, а оно не нагревается. Куда же девается энергия тепла, которую мы расходуем? Чтобы ответить на этот вопрос, надо заглянуть внутрь тела.
В твердом теле молекулы расположены в определенном порядке в виде кристаллов. Они практически не двигаются, лишь слегка колеблясь на месте. Для того, чтобы вещество перешло в жидкое состояние, молекулам необходимо придать дополнительную энергию, чтобы они смогли вырваться от притяжения соседних молекул в кристалликах. Нагревая тело, мы придаем молекулам эту необходимую энергию. И вот пока все молекулы не получат достаточно энергии и не разрушатся все кристаллики, температура тела не повышается. Опыты показывают, что для разных веществ одной массы требуется разное количество теплоты для полного его расплавления.
То есть существует определенная величина, от которой зависит, сколько тепла необходимо поглотить веществу для расплавления. И величина эта различна для разных веществ. Эта величина в физике называется удельная теплота плавления вещества. Опять же, вследствие опытов установлены значения удельной теплота плавления для различных веществ и собраны в специальные таблицы, из которых можно почерпнуть эти сведения. Обозначают удельную теплоту плавления греческой буквой λ (лямбда), а единицей измерения является 1 Дж/кг.
Формула удельной теплоты плавления
Удельная теплота плавления находится по формуле:
λ=Q/m,
где Q – это количество теплоты, необходимое для того, чтобы расплавить тело массой m.
Опять-таки из опытов известно, что при отвердевании вещества выделяют такое же количество тепла, которое требовалось затратить на их расплавление. Молекулы, теряя энергию, образуют кристаллы, будучи не в силах сопротивляться притяжению других молекул. И опять-таки, температура тела не будет понижаться вплоть до того момента, пока не отвердеет все тело, и пока не выделится вся энергия, которая была затрачена на его плавление. То есть удельная теплота плавления показывает, как сколько надо затратить энергии, чтобы расплавить тело массой m, так и сколько энергии выделится при отвердевании данного тела.
Для примера, удельная теплота плавления воды в твердом состоянии, то есть, удельная теплота плавления льда равна 3,4*105 Дж/кг. Эти данные позволяют рассчитать, сколько потребуется энергии, чтобы расплавить лед любой массы. Зная также удельную теплоемкость льда и воды, можно рассчитать, сколько точно потребуется энергии для конкретного процесса, например, расплавить лед массой 2 кг и температурой — 30˚С и довести получившуюся воду до кипения. Такие сведения для различных веществ очень нужны в промышленности для расчета реальных затрат энергии при производстве каких-либо товаров.
Нужна помощь в учебе?
Предыдущая тема: График плавления: разбираем график на примере льда
Следующая тема:   Испарение и кипение: как происходит процесс, особенности
Все неприличные комментарии будут удаляться.

 Удельная теплота плавления металлов
Удельная теплота плавления металлов